2021-2022學年廣西三新學術聯盟高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(本大題共16題,每小題3分,共48分。在每小題列出的4個備選項中,只有一項符合題目要求,多選、錯選或未選均不得分)
-
1.下列物質的性質與用途不具有對應關系的是( )
A.高壓鈉燈發出的黃光透霧能力強,可用于道路和廣場照明 B.金屬鋁有好的延展性,常用鋁箔做包裝材料 C.生石灰能與水反應,常用作食品脫氧劑 D.Ca(ClO)2具有強氧化性,常用作游泳池消毒劑 組卷:8引用:2難度:0.7 -
2.分類法是學習化學的重要方法。下列物質或變化不能按照對應的分類標準歸類的是( )
選項 物質或變化 分類標準 A Na2O、Al2O3、FeO 堿性氧化物 B 石墨、金剛石、C60 同素異形體 C Na2CO3、NaHCO3、Cu2(OH)2CO3 碳酸鹽 D 鋼鐵生銹、食物變質、紙張燃燒 化學變化 A.A B.B C.C D.D 組卷:40引用:1難度:0.9 -
3.下列有關化學用語表示正確的是( )
A.中子數為16的磷原子 P1615B.18O2的摩爾質量是36 C.氟原子的結構示意圖: 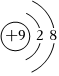
D.原子結構示意圖 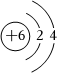 可以表示12C,也可以表示14C組卷:8引用:1難度:0.7
可以表示12C,也可以表示14C組卷:8引用:1難度:0.7 -
4.下列說法正確的是( )
A.釷有232Th和230Th兩種同位素,所以元素Th的近似相對原子質量是231 B.O2和O3的相互轉化屬于化學變化 C.H2、D2和T2互為同位素 D.元素周期表一共有18縱列,每個縱列為一個族 組卷:17引用:1難度:0.8 -
5.下列方程式,不能正確表達反應顏色變化的是( )
A.Na2O2在空氣中放置后由淡黃色變為白色:2Na2O2═2Na2O+O2↑ B.向飽和Na2CO3溶液中通入足量的CO2生成白色沉淀:Na2CO3+CO2+H2O═2NaHCO3↓ C.白色的Fe(OH)2在空氣中迅速變為灰綠色,最終變為紅褐色:4Fe(OH)2+O2+2H2O═4Fe(OH)3 D.在FeCl3溶液中通入H2S氣體,生成黃色沉淀:2FeCl3+H2S═2FeCl2+S↓+2HCl 組卷:25引用:1難度:0.7 -
6.下列離子方程式正確的是( )
A.碳酸氫鈣溶液與過量燒堿溶液混合:Ca2++HCO3-+OH-═CaCO3↓+H2O B.漂白粉溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO C.Fe與NaHSO4溶液反應:Fe+2HSO4-═Fe2++H2↑+2SO42- D.用氫氧化鋇溶液中和硫酸溶液:Ba2++OH-+H++SO42-═H2O+BaSO4↓ 組卷:72引用:1難度:0.7 -
7.在某澄清透明的溶液中,能大量共存的離子組是( )
A.Na+、OH-、Ba2+、HCO3- B.ClO-、Na+、I-、K+ C.Fe3+、Na+、Cl-、SCN- D.K+、Na+、SO42-、MnO4- 組卷:103引用:3難度:0.5
二、非選擇題(本大題共4題,共52分)
-
20.某同學在實驗室中制備并收集干燥純凈的氯氣,可供選用的儀器及藥品如圖所示:
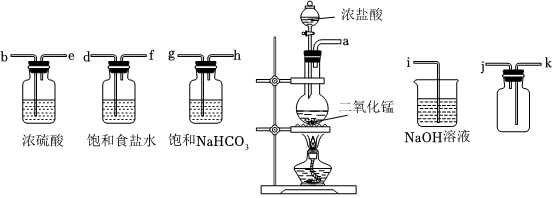
(1)上述實驗制取氯氣的化學反應方程式為,其中還原劑和氧化產物物質的量之比為。
(2)從上述儀器中選擇必要儀器并按順序連接(填各接口處的字母):。
(3)如圖所示,在A處通入干燥純凈的氯氣。當打開B處的彈簧夾時,C處的紅布條看不到明顯現象:當關閉B處的彈簧夾后,C處的紅布條逐漸褪色。則D瓶中盛放的溶液可能是(填字母)。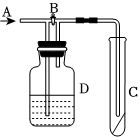
A.飽和NaCl溶液
B.NaOH溶液
C.濃硫酸
(4)工業上通常將氯氣通入石灰乳中制備漂白粉,請寫出該反應的化學方程式。
(5)FeI2是一種灰黑色的固體,某研究性學習小組為了探究它的還原性,進行了如下實驗:取一定量的FeI2溶液,向其中滴加少量新制的氯水,振蕩后溶液呈黃色。某同學對產生黃色的原因提出了假設:
假設1:①。
假設2:Fe2+被Cl2氧化
請你完成下表,驗證假設實驗步驟 預期現象 結論 Ⅰ.取少量黃色溶液于試管中,滴加淀粉溶液 ② 假設1正確 Ⅱ.取少量黃色溶液于試管中,滴加③ ④ 假設2正確 組卷:15引用:1難度:0.6 -
21.硫酸亞鐵是一種補鐵劑,某興趣小組利用經初步處理的含有Fe2+的廢液制備硫酸亞鐵晶體的流程如圖:

(1)加入飽和NaHCO3溶液后,得到白色沉淀,則操作1為,若NaHCO3溶液濃度偏低可能會形成膠體,驗證的方法為。
(2)加入鐵粉的作用是。
(3)測定廢液中Fe2+的濃度可使用已知濃度的酸性高錳酸鉀溶液,請配平以下方程式,并用單線橋法表示電子轉移過程:KMnO4+FeSO4+H2SO4═MnSO4+K2SO4+Fe2(SO4)3+H2O。
(4)該興趣小組在研究硫酸亞鐵(FeSO4)熱穩定性時,作出了兩種假設:
①假設一:按CaCO3受熱分解的方式分解,則FeSO4受熱分解的化學方程式為;
②假設二:按KClO3受熱分解的方式分解,且產物中有一種堿性氧化物和兩種酸性氧化物生成,則FeSO4受熱分解的化學方程式為。
(5)Fe2+和Fe3+的相互轉化可用于物質含量的測定,如測定某氯化亞銅樣品中CuCl的含量,流程如圖:準確稱取氯化亞銅樣品mg,將其置于過量的FeCl3溶液中,發生以下反應:FeCl3+CuCl═FeCl2+CuCl2,待固體完全溶解后,加入適量稀硫酸,用amol?L-1的K2Cr2O7溶液氧化反應生成的Fe2+(該條件下Cl-不被氧化),消耗K2Cr2O7溶液bmL,反應中Cr2被還原為Cr3+。則樣品中CuCl的質量分數為O2-3。組卷:17引用:1難度:0.5


