2022-2023學年湖南省長沙市長郡中學高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括10小題,每小題3分,共30分.在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.2007年2月,中國首條“生態馬路”在上海復興路隧道建成,它運用了“光觸媒”技術,在路面涂上一種光催化劑涂料,可將汽車尾氣中45%的NO和CO轉化成N2和CO2.下列對此反應的敘述中正確的是( )
A.使用光催化劑不改變反應速率 B.使用光催化劑能增大NO的轉化率 C.升高溫度能加快反應速率 D.改變壓強對反應速率無影響 組卷:83引用:28難度:0.9 -
2.下列說法正確的是( )
A.一定溫度下,反應MgCl2(l) Mg(l)+Cl2(g)的ΔH>0,ΔS<0通電B.凡是放熱反應都是自發的,凡是吸熱反應都是非自發的 C.常溫下,2H2O 2H2↑+O2↑,即常溫下水的分解反應是自發反應通電D.已知2KClO3 (s)═2KCl(s)+3O2(g) ΔH=-78.03 kJ?mol-1,ΔS=+494.4 J?mol-1?k-1,此反應在任何溫度下都能自發進行 組卷:81引用:4難度:0.6 -
3.某科研人員提出HCHO與O2在羥基磷灰石(HAP)表面催化氧化生成CO2、H2O的歷程,該歷程示意圖如圖(圖中只畫出了HAP的部分結構)。下列敘述錯誤的是( )
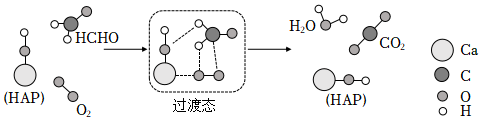
A.該歷程中HCHO中所有的C-H鍵均斷裂 B.該過程的總反應為HCHO+O2 CO2+H2OHAPC.該反應中反應物的總能量低于生成物的總能量 D.生成物CO2中的氧原子由HCHO和O2共同提供 組卷:24引用:6難度:0.6 -
4.Burns和Dainton研究發現Cl2與CO合成COCl2的反應機理如下:
①Cl2(g)?2Cl?(g)快
②CO(g)+Cl?(g)?COCl?(g)快
③COCl?(g)+Cl2(g)?COCl2(g)+Cl?(g)慢
反應②的速率方程為v正=k正c(CO)×c(Cl?),v逆=k逆c(COCl?),下列說法錯誤的是( )A.反應①的活化能大于反應③的活化能 B.反應②的平衡常數K= k正k逆C.要提高合成COCl2的速率,關鍵是提高反應③的速率 D.選擇合適的催化劑能提高單位時間內COCl2的產率 組卷:167引用:5難度:0.4 -
5.常溫下,現有pH=3的鹽酸和醋酸溶液,下列說法正確的是( )
A.兩種酸溶液中c(CH3COO-)=c(Cl-) B.分別加水稀釋10倍后溶液的pH均變為4 C.中和等物質的量的氫氧化鈉,消耗酸的體積:鹽酸<醋酸 D.等體積的兩種酸溶液分別與足量的鋅粒反應,產生氣體的體積相等 組卷:16引用:5難度:0.6 -
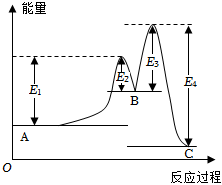 6.反應A→C分兩步進行:①A→B,②B→C.反應過程能量變化曲線如圖所示(E1、E2、E3、E4表示活化能).下列說法錯誤的是( )
6.反應A→C分兩步進行:①A→B,②B→C.反應過程能量變化曲線如圖所示(E1、E2、E3、E4表示活化能).下列說法錯誤的是( )A.三種物質中B最不穩定 B.A→B反應的活化能為E1 C.B→C反應的△H=E4-E3 D.加入催化劑不能改變反應的焓變 組卷:110引用:8難度:0.5
三、非選擇題(本題包括4小題,共54分)
-
17.Ⅰ.磷能形成多種含氧酸.
(1)次磷酸(H3PO2)是一種精細化工產品,向10mLHH3PO2溶液中加入20mL等物質的量濃度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-兩種陰離子.
①寫出H3PO2溶液與足量NaOH溶液反應后形成的正鹽的化學式:.
②常溫下,K(H3PO2)=5.9×10-2,0.1mol/L的H3PO2溶液在加水稀釋過程中,下列表達式的數據一定變小的是(填標號).
A.c(H+)
B.c(H3PO2)c(H+)
C.c(H+)?c(H2PO-2)c(H3PO2)
(2)亞磷酸(H3PO3)是二元中強酸,25℃時亞磷酸的電離常數為K1=5.0×10-2、K2=2.6×10-7.試從電離平衡移動的角度解釋K1、K2數據的差異:.
(3)25℃時,HF的電離常數為K=3.6×10-4;H3PO4的電離常數為K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13.足量NaF溶液和H3PO4溶液反應的離子方程式為.
(4)①相同溫度下,等物質的量濃度的上述三種磷的含氧酸中,c(H+)由大到小的順序為(用酸的分子式表示).
②已知:OH-(aq)+H+(aq)═H2O ΔH=-57.3kJ/mol,則0.1mol/LH3PO4溶液與足量0.1mol/LNaOH溶液反應生成1molH2O(1)放出的熱量為(填標號).
A.=57.3kJ
B.<57.3kJ
C.>57.3kJ
D.無法確定
Ⅱ.已知25℃時N2H4水溶液呈弱堿性:N2H4+H2O?N2H5++OH-K1=1×10-a;N2H5++H2O?N2H62++OH-K2=1×10-b.25℃時,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同時c(N2H5+)>c(N2H62+),應控制溶液中c(OH-)的范圍為(用含a、b式子表示).組卷:28引用:1難度:0.5 -
18.亞氯酸鈉(NaClO2)是一種高效含氯消毒劑和漂白劑。如圖為制備亞氯酸鈉的裝置圖(夾持裝置省略)。
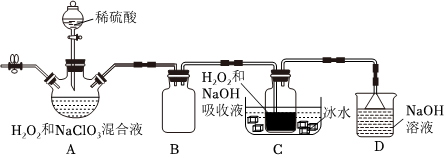
已知:NaClO2飽和溶液在低于38℃時會析出NaClO2?3H2O,高于38℃時析出NaClO2,高于60℃時NaClO2分解成NaClO3和NaCl。試回答下列問題:
(1)裝置A用來制取ClO2,發生反應的離子方程式為。
(2)裝置B的作用是。
(3)研究測得C裝置吸收液中c(NaOH)、對粗產品中NaClO2含量的影響如圖所示。則最佳條件為c(NaOH)=c(H2O2)n(NaOH)mol?L-1,═c(H2O2)n(NaOH)。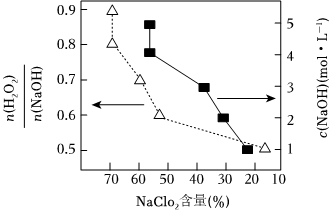
(4)C裝置中生成NaClO2的反應,=n(氧化劑)n(還原劑);C裝置采用“冰水浴“防止溫度過高的目的是。
(5)充分反應后,為從產品溶液中獲取NaClO2晶體,從下列選項中選出合理的操作并排序:→→→干燥(填字母序號)。
a趁熱過濾
b.50℃水洗滌
c.加熱蒸發結晶
d.冰水洗滌
e.55℃恒溫減壓蒸發結晶組卷:19引用:2難度:0.5


