2018-2019學年陜西省渭南市韓城市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共16小題每小題3分,計48分。每小題只有一個選項是符合題意的)
-
1.強弱電解質的本質區別是( )
A.電離程度 B.相對分子質量 C.導電能力 D.溶解度 組卷:12引用:1難度:0.6 -
2.一定溫度下,能夠用于判斷一個反應是不是自發過程的依據是( )
A.只與焓變有關 B.只與熵變有關 C.由焓變和熵變共同決定 D.與焓變、熵變皆無關 組卷:74引用:4難度:0.8 -
3.鋼鐵發生吸氧腐蝕時,正極上發生的電極反應是( )
A.2H++2e-═H2↑ B.Fe2++2e-═Fe C.2H2O+O2+4e-═4OH- D.Fe3++e-═Fe2+ 組卷:603引用:82難度:0.9 -
4.在一定條件下,可逆反應2N2O5(g)?4NO2(g)+O2(g)中,的物質的量濃度c(NO2)隨時間變化的實驗數據如下表所示:根據表中數據,該反應達到平衡時c(NO2)為( )
時間/min 0 5 10 15 20 25 c(NO2)/(mol?L-1) 0 0.020 0.032 0.038 0.040 0.040 A.0.020mol?L-1 B.0.032mol?L-1 C.0.038mol?L-1 D.0.040mol?L-1 組卷:22引用:10難度:0.9 -
5.中和熱測定實驗中量取反應物時,除50mL 0.50mol?L-1的鹽酸之外,還需加入的試劑是( )
A.50mL 0.50mol?L-1氨水 B.50mL 0.55mol?L-1NaOH溶液 C.1.0g NaOH固體 D.1.1g NaOH固體 組卷:7引用:1難度:0.8 -
6.反應2SO2+O2?2SO3經amin后,SO3濃度的變化情況如圖所示,在時間0-amin內用O2表示的平均反應速率為0.04mol/(L?min),則a等于( )
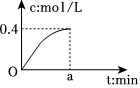
A.0.1 B.2.5 C.5 D.10 組卷:83引用:7難度:0.9 -
7.將25℃的純水加熱至80℃,下列敘述正確的是( )
A.水的離子積不變,呈中性 B.水中c(H+)=c(OH-)>1×10-7 mol/L C.水的pH變大,呈中性 D.水的pH變小,呈酸性 組卷:60引用:2難度:0.9
二、非選擇題(本大題共5小題,計52分)
-
20.三氯氫硅(SiHCl3)是制備硅烷、多晶硅的重要原料,回答下列問題
(1)SiHCl2在催化劑作用下發生反應
2SiHCl3(g)═SiH2Cl2(g)+SiCl4(g)△H═+48kJ?mol-1
4SiHCl3(g)═SiH4(g)+3SiCl4(g)△H═+114kJ?mol-1
則反應3SiH2Cl2(g)═SiH4(g)+2SiHCl3(g)的△H═kJ?mol-1
(2)對于反應2SiHCl3(g)═SiH2Cl2(g)+SiCl4(g),采用合適的催化劑,在323K和343K時SiHCl2的轉化率隨時間變化的結果如圖所示。
①323K時反應的平衡轉化率為。343K時,反應的平衡常數K═。(精確到0.01)
②比較a、b處反應速率的大小:vavb(填“>”、“<”或“═”)。
③在343K下,要提高SHCl3的平衡轉化率,可采取的措施是(填字母,下同);要縮短反應達到平衡的時間,可采取的措施有。(兩空均從下列選項中選擇合適的選項)
A.增大反應物濃度
B.增大壓強
C.及時將產物從體系分離
D.使用更高效的催化劑
④TK下,該反應可使SiHCl3的平衡轉化率達到30%,則該溫度下的平衡常數KTKK343K(填“><”或“═”)組卷:8引用:1難度:0.6 -
21.鹽溶液受鹽的水解影響,導致性質具有一定的復雜性。
(1)AlCl3的水溶液pH7(填“>”、“═”或“<”),將其溶液加熱蒸干并灼燒,最終得到的物質是。(填化學式)
(2)物質的量濃度相同的三種溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)由大到小的順序是。(用序號表示)
(3)已知Ksp[Cu(OH)2]═2×10-20,常溫下某CuSO4溶液中c(Cu2+)═2.0mol?L-1,若要生成Cu(OH)2沉淀,應調整溶液的pH大于。
(4)常溫下將0.1mol?L-1的醋酸和0.1mol?L-1的NaOH溶液等體積混合,所得混合溶液的pH═8。則該混合溶液中c(Na+)-c(CH3COO-)═。
(5)已知25℃時,0.1mol?L-1醋酸溶液的pH約為3,向其中加入醋酸鈉晶體,晶體溶解后,溶液的pH增大。對上述現象有兩種不同的解釋:
甲同學:醋酸鈉水解呈堿性,增大了c(OH-),因而溶液的pH增大;
乙同學:醋酸鈉溶于水電離出大量醋酸根離子,抑制了醋酸的電離,使c(H+)減小,因此溶液的pH增大。
上述兩種解釋中(填“甲”或“乙”)正確。組卷:6引用:1難度:0.7


