2021-2022學年遼寧省沈陽市沈河區同澤高級中學高一(上)月考化學試卷
發布:2024/4/20 14:35:0
一.單項選擇(20題,每題3分,共60分)
-
1.在科學史上中國有許多重大的發明和發現,它們為世界的現代化奠定了基礎,以下發明和發現屬于化學史上中國對世界的貢獻的是( )
①火藥
②指南針
③造紙
④印刷技術
⑤煉銅、煉鐵、煉鋼
⑥合成有機高分子材料
⑦人工合成蛋白質
⑧提出原子-分子學說A.②③⑥⑧ B.①③⑤⑦ C.④⑤⑦⑧ D.①③④⑧ 組卷:13引用:4難度:0.9 -
2.日常生活中的許多現象與化學反應有關,下列現象與氧化還原反應無關的是( )
A.  銅器變綠
銅器變綠B. 
菜刀生銹C.  燃料爆炸
燃料爆炸D. 
白醋去水垢組卷:8引用:1難度:0.7 -
 3.氧化還原反應與四種基本反應類型的關系如圖所示,則下列化學反應屬于區域3的是( )
3.氧化還原反應與四種基本反應類型的關系如圖所示,則下列化學反應屬于區域3的是( )A.4FeS2+11O2 2Fe2O3+8SO2高溫B.4Na+O2═2Na2O C.Zn+CuSO4═ZnSO4+Cu D.2KMnO4 K2MnO4+MnO2+O2↑△組卷:41引用:2難度:0.5 -
4.下列物質按純凈物、混合物、強電解質、弱電解質、非電解質的組合中,正確的是( )
選項 純凈物 混合物 強電解質 弱電解質 非電解質 A 鹽酸 水煤氣 硫酸 次氯酸 水銀 B 冰醋酸 福爾馬林 苛性鈉 碘化氫 乙醇 C 火堿 蔗糖溶液 氯化鈉 氨水 三氧化硫 D 膽礬 氯水 硫酸鋇 氟化氫 氨氣 A.A B.B C.C D.D 組卷:10引用:1難度:0.8 -
5.下列說法中正確的是( )
(1)酸性氧化物在一定條件下均能與堿發生反應
(2)與水反應生成堿的氧化物不一定是堿性氧化物
(3)鎂、鋁和銅可以分別用置換法、直接加熱法和電解法冶煉得到
(4)金屬氧化物不一定都是堿性氧化物,但堿性氧化物一定都是金屬氧化物
(5)有單質參加的反應,一定是氧化還原反應
(6)任何溶膠加入可溶性電解質后都能使膠體粒子凝成較大顆粒形成沉淀析出
(7)丁達爾現象、布朗運動、電泳現象都是膠體的物理性質
(8)因為膠粒比溶液中溶質粒子大,所以膠體可以用過濾的方法把膠粒分離出來
(9)膠體穩定存在的主要原因是膠體帶電
(10)硫酸、純堿、醋酸鈉和生石灰分別屬于酸、堿、鹽和氧化物
(11)蔗糖、硫酸鋇和水分別屬于非電解質、強電解質和弱電解質A.7個 B.8個 C.5個 D.6個 組卷:24引用:2難度:0.4 -
6.以下各組離子能在溶液中大量共存的是( )
A.含有大量 的溶液:加入Mg2+、Cu2+、Cl-、SO2-4NO-3B.滴加酚酞變紅的溶液:加入 、Cu2+、K+、Cl-SO2-4C.所含溶質為NaHSO4的溶液:加入K+、 、CO2-3、Na+NO-3D.常溫下,加入鐵粉能生成H2的溶液:加入Na+、Ca2+、Cl-、 HCO-3組卷:45引用:5難度:0.7 -
7.對于下列反應的說法中正確的是( )
A.2CuFeS2+O2═Cu2S+2FeS+SO2,CuFeS2是氧化劑,O2是還原劑 B.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,氧化劑與還原劑的物質的量之比為2:3 C.KClO3+6HCl(濃)═KCl+3Cl2↑+3H2O,生成3molCl2,轉移電子6mol D.Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,說明還原性:Cr3+>Fe2+ 組卷:102引用:2難度:0.5 -
8.向飽和NaCl溶液中依次通入NH3、CO2氣體,發生反應:NaCl+NH3+H2O+CO2═NH4Cl+NaHCO3↓,產生的NaHCO3經煅燒可得純堿,這是侯氏制堿法的基本原理。下列說法錯誤的是( )
A.該反應的離子方程式為Na++NH3+CO2+H2O═NaHCO3↓+NH4+ B.NaHCO3的電離方程式為 NaHCO3═Na++HCO3- C.因為NaCl、NH4Cl均易溶于水,故NaCl、NH4Cl均是電解質 D.侯氏制堿法中的“堿”指的是Na2CO3 組卷:46引用:3難度:0.7
二.填空題(4個小題,共40分)
-
24.亞氯酸鈉(NaClO2)是一種強氧化性漂白劑,廣泛用于紡織、印染和食品工業。它在破性環境中穩定存在。某同學查閱資料后設計生產NaClO2的主要流程如圖所示(部分產品未標出)。
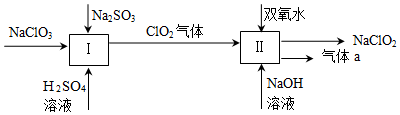
(1)Ⅰ中發生反應的還原劑是(填名稱),Ⅱ中發生反應的氧化劑是(填化學式)。
(2)Ⅱ中反應的離子方程式是。
(3)ClO2是一種高效水處理劑,可用NaClO2和稀鹽酸為原料制備:
①試寫出該反應方程式。
②研究表明:在上述過程中會發生副反應NaClO2+4HCl═NaCl+2ClO2↑+2H2O,若反應開始時鹽酸濃度越大,則氣體產物中C的含量越大。請推測其原因是。組卷:25引用:2難度:0.5 -
25.某化學興趣小組探究溶液中離子濃度與溶液導電能力關系的裝置如圖所示。首先在水槽中加入200mL一定濃度的稀硫酸,同時將一個表面光滑的小球(與稀硫酸不反應)放入溶液中,小球懸浮在溶液中央,閉合開關K,電流表指針發生偏轉。

(1)向溶液中逐滴加入與稀硫酸密度相同的Ba(OH)2溶液(設反應后溶液的體積為兩溶液的體積之和)至反應完全,觀察到的現象是,發生反應的離子方程式是。
(2)將Ba(OH)2溶液換成濃度相同(假設密度也相同)的以下三種溶液(設反應后溶液的體積為兩溶液的體積之和):Ba (NO3)2溶液、Na2SO4溶液、Na2CO3溶液。
①滴加Ba(NO3)2溶液的過程中,觀察到的現象是,發生反應的離子方程式是。
②滴加Na2SO4溶液的過程中,小球的位置,電流表指針的偏轉角度。
③滴加Na2CO3溶液的過程中,觀察到的現象是,發生反應的離子方程式是。組卷:17引用:1難度:0.6


