2013-2014學年重慶市楊家坪中學高一(下)暑假化學作業(4)
發布:2024/4/20 14:35:0
一、選擇題
-
1.下列關于堿金屬元素的敘述錯誤的是( )
A.隨核電荷數遞增,堿金屬單質的熔沸點逐漸減小 B.隨核電荷數遞增,堿金屬單質的密度逐漸增大(Na、K反常) C.堿金屬元素包括F、Cl、Br、I、At五種元素 D.堿金屬元素的原子最外層都只有一個電子 組卷:44引用:3難度:0.9 -
2.下列離子方程式正確的是( )
A.少量的鈉跟足量鹽酸反應:2Na+2H2O═2Na++2OH-+H2↑ B.過量Cl2通向濕潤的淀粉KI試紙,先變藍后褪去:Cl2+2I-═2Cl-+I2 C.Ba(HCO3)2溶液與Ba(OH)2溶液任意比混合:Ba2++HCO3-+OH-═BaCO3↓+H2O D.向濃HNO3溶液中加入足量的鐵粉:Fe+2NO3-+4H+═Fe2++2NO2↑+2H2O 組卷:466引用:2難度:0.1 -
3.下列說法正確的是(其中NA表示阿伏加德羅常數)( )
A.質子數相等、中子數不等的微粒一定屬于同位素 B.比黃金還貴的18O2和普通的16O2是兩種不同的核素 C.常溫常壓下,0.1mol D216O中含中子數、質子數、電子數均為NA D.對人體有害元素氡的放射性同位素22286Rn,其原子中的質子數為136 組卷:4引用:4難度:0.9 -
4.下列離子一定能夠大量共存的是( )
A.含有大量Al3+的溶液中:K+、Na+、Cl-、NO3- B.含有大量Fe3+的溶液中:Cu2+、Fe2+、I-、SO42- C.石蕊呈紅色的溶液中:Na+、AlO2-、NO3-NH4- D.在通入了Cl2的溶液中:K+、Cl-、Fe2+、SO42- 組卷:6引用:2難度:0.7 -
5.下列化合物中,不能由化合反應制得的是( )
A.Fe(OH)3 B.FeCl2 C.Fe(OH)2 D.FeCl3 組卷:129引用:7難度:0.9 -
6.下列實驗過程中,始終無明顯現象的是( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中 C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中 組卷:859引用:113難度:0.7
二、非選擇題(共58分)
-
17.工業上常用鐵質容器盛裝冷濃硫酸.為研究鐵質材料與熱濃硫酸的反應,某學習小組進行了以下探究活動:
[探究一](1)將已除去表面氧化物的鐵釘(碳素鋼)放入冷濃硫酸中,10分鐘后移人硫酸銅溶液中,片刻后取出觀察,鐵釘表面無明顯變化,其原因是.
(2)另稱取鐵釘6.0g放入15.0mL濃硫酸中,加熱,充分應后得到溶液X并收集到氣體Y.
①甲同學認為X中除Fe3+外還可能含有Fe2+.若要確認其中的Fe2+,應選用(選填序號).
a.KSCN溶液和氯水 b.鐵粉和KSCN溶液 c.濃氨水 d.酸性KMnO4溶液
②乙同學取336mL(標準狀況)氣體Y通入足量溴水中,發生反應:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,經適當操作后得干燥固體2.33g.由于此推知氣體Y中SO2的體積分數為.
[探究二]分析上述實驗中SO2體積分數的結果,丙同學認為氣體Y中還可能含量有H2和Q氣體.為此設計了下列探究實驗裝置(圖中夾持儀器省略).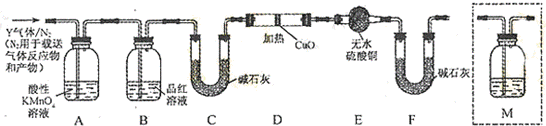
(3)裝置B中試劑的作用是.
(4)認為氣體Y中還含有Q的理由是(用化學方程式表示).
(5)為確認Q的存在,需在裝置中添加M于(選填序號).
a.A之前 b.A-B間 c.B-C間 d.C-D間
(6)如果氣體Y中含有H2,預計實驗現象應是.組卷:61引用:15難度:0.5 -
18.在50mL a mol/L的硝酸溶液中,加入6.4g Cu,全部溶解,假設硝酸的還原產物只有NO2和NO,將反應后溶液用蒸餾水稀釋至100mL時測得c(NO3-)=3mol/L.
(1)求稀釋后的溶液中c(H+)=mol/L
(2)若a=9,則生成的氣體中NO2的物質的量為mol
(3)治理氮氧化物污染的方法之一是用NaOH溶液進行吸收,反應原理如下:NO2+NO+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O若將上述的NO2和NO的混合氣體通入1mol/L的NaOH恰好被吸收,NaOH溶液的體積為mL.組卷:4引用:4難度:0.5


