魯科版(2019)選擇性必修1《2.3 化學反應的速率》2021年同步練習卷(6)
發布:2024/4/20 14:35:0
一、單選題
-
1.反應C(s)+H2O(g)?CO(g)+H2(g)在一容積可變的密閉容器中進行,在其它條件不變的情況下,下列條件的改變對其反應速率幾乎無影響的是( )
A.保持體積不變,增加H2O(g)的物質的量 B.將容器的體積縮小一半 C.保持體積不變,充入N2使體系壓強增大 D.保持壓強不變,充入N2使容器體積變大 組卷:35引用:6難度:0.7 -
2.在氣體反應中,能使反應物中活化分子數和活化分子百分數同時增加的方法是( )
A.增大反應物濃度 B.升高溫度 C.增大壓強 D.加入正催化劑 組卷:36引用:2難度:0.3 -
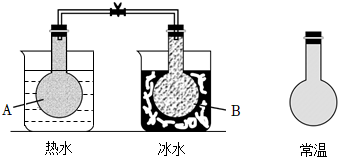 3.已知反應:2NO2(g)?N2O4(g),把NO2、N2O4的混合氣體盛裝在兩個連通的燒瓶里,然后用夾子夾住橡皮管,把燒瓶A放入熱水里,把燒瓶B放入冰水里,如圖所示.與常溫時燒瓶內氣體的顏色進行對比發現,A燒瓶內氣體顏色變深,B燒瓶內氣體顏色變淺.下列說法錯誤的是( )
3.已知反應:2NO2(g)?N2O4(g),把NO2、N2O4的混合氣體盛裝在兩個連通的燒瓶里,然后用夾子夾住橡皮管,把燒瓶A放入熱水里,把燒瓶B放入冰水里,如圖所示.與常溫時燒瓶內氣體的顏色進行對比發現,A燒瓶內氣體顏色變深,B燒瓶內氣體顏色變淺.下列說法錯誤的是( )A.反應2NO2(g)?N2O4(g)的正反應為吸熱反應 B.上述過程中,A燒瓶內正、逆反應速率均加快 C.上述過程中,B燒瓶內c(NO2)減小,c(N2O4)增大 D.上述過程中,A、B燒瓶內氣體密度均保持不變 組卷:24引用:3難度:0.7 -
4.在1L密閉容器中,把1mol A和1mol B混合發生如下反應:3A(g)+B(g)?xC(g)+2D(g),當反應達到平衡時,生成0.4mol D,并測得C的平衡濃度為0.4mol/L,下列敘述中不正確的是( )
A.x的值為2 B.A的轉化率為60% C.B的平衡濃度為0.8 mol/L D.D的體積分數為25% 組卷:111引用:10難度:0.7 -
5.在一密閉容器中的一定量混合氣體發生反應:xA(g)+yB(g)?zZ(g)平衡時測得A的濃度為0.50mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達到平衡時,A的濃度為0.30mol/L.下列有關判斷正確的是( )
A.x+y<z B.平衡向正反應方向移動 C.物質B的轉化率降低 D.物質Z的體積分數增大 組卷:136引用:6難度:0.5 -
6.已知反應A?2B,A、B的濃度變化如圖所示,下列反應速率正確的是( )
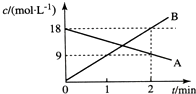
A.v(A)=9 mol/(L?min) B.v(B)=18 mol/(L?min) C.v(A)=4.5 mol/(L?min) D.v(B)=4.5 mol/(L?min) 組卷:56引用:3難度:0.9
二、綜合題
-
17.在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)?CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
回答下列問題:t℃ 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6
(1)該反應的化學平衡常數表達式為;
(2)反應是反應。(選填“吸熱”、放熱)。
(3)能判斷該反應是否達到化學平衡狀態的依據是。
a.容器中壓強不變
b.混合氣體中c(CO)不變
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),試判斷此時的溫度為℃組卷:459引用:130難度:0.1 -
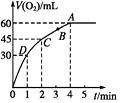 18.加0.1mol MnO2粉末于50mL過氧化氫溶液(H2O2,ρ=1.1 g?mL-1)中,在標準狀況下放出氣體的體積和時間的關系如圖所示。
18.加0.1mol MnO2粉末于50mL過氧化氫溶液(H2O2,ρ=1.1 g?mL-1)中,在標準狀況下放出氣體的體積和時間的關系如圖所示。
(1)實驗時放出氣體的總體積是。
(2)放出一半氣體所需時間為。
(3)A、B、C、D各點反應速率由快到慢的順序為。
(4)解釋反應速率變化的原因。組卷:7引用:1難度:0.6


