2015-2016學年重慶八中高二(下)暑期化學試卷(4)
發布:2024/4/20 14:35:0
一、選擇題
-
1.Al、Fe、Cu都是重要而常見的金屬,下列有關說法正確的是( )
A.三者的單質在常溫下都能溶于濃硫酸和濃硝酸 B.三者的單質放置在空氣中均只生成氧化物 C.三者所對應的氫氧化物在水中都存在溶解平衡 D.工業上制備這三種金屬的方法依次為電解法、熱分解法和熱還原法 組卷:61引用:9難度:0.7 -
2.下列各物質中,不能由組成它的兩種元素的單質直接化合得到的是( )
A.FeS B.FeCl2 C.FeCl3 D.Fe3O4 組卷:77引用:14難度:0.9 -
3.已知:2Fe+3Br2=2FeBr3 2Fe3++2I-=2Fe2++I2 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,現將Fe(NO3)2溶液分別滴入到以下溶液中:①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+轉變成Fe3+的是( )
A.只有②③ B.①②③ C.②③④ D.全部 組卷:156引用:10難度:0.7
二、解答題
-
10.為了保護環境,充分利用資源,某研究小組通過如下簡化流程,將工業制硫酸的硫鐵礦燒渣(鐵主要以Fe2O3存在)轉變成重要的工業原料FeSO4(反應條件略)。
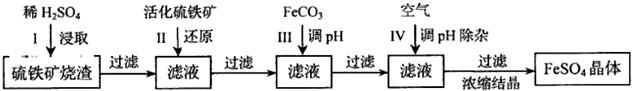
活化硫鐵礦還原Fe3+的主要反應為:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考慮其他反應,請回答下列問題:
(1)第1步H2SO4與Fe2O3反應的離子方程式是
(2)檢驗第II步中Fe3+是否完全還原,應選擇(填字母編號)。
A.KMnO4溶液 B.淀粉--KI溶液 C.KSCN溶液
(3)第III步加FeCO3調溶液pH到5.8左右,然后在第IV步通入空氣使溶液pH降到5.2,此時Fe2+不沉淀,濾液中鋁、硅雜質除盡。通入空氣引起溶液pH降低的原因是
(4)FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料,該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+FeS2=Fe+2Li2S,正極反應式是。
(5)FeSO4可轉化為FeCO3,FeCO3在空氣中加熱反應可制得鐵系氧化物材料。已知25℃,101kPa時:
4Fe(s)+3O2(g)=2Fe2O3(s)△=-1648kJ/mol
C(s)+O2(g)=CO2(g)△=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△=-1480kJ/mol
FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是
(6)假如燒渣中的鐵全部視為Fe2O3,其含量為p。將b kg質量分數為c的硫酸加入到a kg燒渣中浸取,鐵的浸取率為q,其他雜質浸出消耗掉的硫酸以及調pH后溶液呈微酸性所殘留的硫酸忽略不計。按上述流程,第III步應加入FeCO3kg。組卷:5引用:1難度:0.5
選做題
-
11.鐵是人類較早使用的金屬之一。運用所學知識,回答下列問題。
(1)鑒別Fe(OH)3膠體和FeCl3溶液的方法是
(2)電子工業用FeCl3溶液腐蝕敷在絕緣板上的銅,制造印刷電路板,請寫出FeCl3溶液與銅反應的離子方程式:。
(3)某研究性學習小組為測定FeCl3腐蝕銅后所得溶液的組成,進行了如下實驗:
①取少量待測溶液,滴入KSCN溶液呈紅色,則待測液中含有的金屬陽離子是;
②溶液組成的測定:取50.0mL待測溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。則溶液中c(Cl-)=
③驗證該溶液中含有Fe2+,正確的實驗方法是。
A.觀察溶液是否呈淺綠色
B.取適量溶液,滴入酸性高錳酸鉀溶液,若褪色,證明含有Fe2+
C.取適量溶液,滴入氯水,再滴入KSCN溶液,若顯血紅色,證明原溶液中含有Fe2+
(4)工程師欲從制造印刷電路板的廢水中回收銅,并獲得FeCl3溶液,設計如下方案: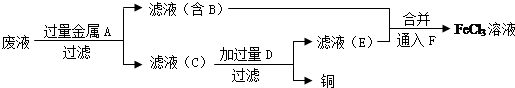
①濾渣C的化學式為。
②加過量D發生反應的離子方程式為。
③通入F發生反應的化學方程式為。組卷:38引用:3難度:0.6


