2022年湖北省襄陽市棗陽一中高考化學三模試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題3分,共45分。每小題只有一個正確選項)
-
1.化學與生活、科技及環境密切相關。下列說法正確的是( )
A.蛋白質、核酸、脂肪及糖類在一定條件下都能水解,其中蛋白質水解的產物是氨基酸 B.多人聚餐使用公筷,推廣綠色出行,這些舉措與“禁塑令”均為應對“碳中和” C.殲-20飛機上用到的氮化鎵材料屬于合金材料 D.屬于油炸食品的薯片長時間開封存放,會發出一股難聞氣味,這是油脂被氧化的結果 組卷:75引用:1難度:0.7 -
2.用化學用語表示COS+4H2O2
CO2+H2SO4+3H2O中的相關微粒,其中正確的是( )Pd硫酸A.中子數56,質量數102的Pd原子: Pd10256B.COS的結構式:O=C=S C.硫原子核外電子排布式:1s22s22p63s23p6 D.H2O2的電子式: 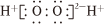 組卷:8引用:3難度:0.6
組卷:8引用:3難度:0.6 -
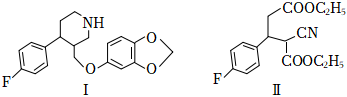 3.治療抑郁癥的藥物帕羅西汀(Ⅰ)及其合成中間體(Ⅱ)的結構簡式如圖所示。下列說法錯誤的是( )
3.治療抑郁癥的藥物帕羅西汀(Ⅰ)及其合成中間體(Ⅱ)的結構簡式如圖所示。下列說法錯誤的是( )A.Ⅰ分子中有3種官能團 B.Ⅰ分子中含兩個手性碳原子 C.Ⅱ分子式為C16H18NO4F D.1molⅡ與足量NaOH溶液反應時最多消耗3molNaOH 組卷:15引用:1難度:0.5 -
4.NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.0.5molSF6中硫的價層電子對數為3NA B.1LpH值等于4的0.1mol?L-1的K2Cr2O7溶液中含有Cr2O72-數為0.1NA C.含2mol共價鍵的水蒸氣,分子間存在2NA個氫鍵 D.密閉容器中1molPCl3與1molCl2反應制備PCl5(g),增加2NA個P-Cl鍵 組卷:9引用:1難度:0.7 -
5.下列實驗操作對應的離子方程式正確的是( )
實驗操作 離子方程式 A AgCl溶于過量氨水 Ag++2NH3?H2O═[Ag(NH3)]++2H2O B 向硫酸銅溶液中加入過量的NaHS溶液 Cu2++2HS-═CuS↓+2H+ C 向氫氧化亞鐵中加入足量的稀硝酸 Fe(OH)2+2H+═Fe2++2H2O D AgI加入Na2S溶液中,固體變黑 S2-(aq)+2AgI(s)═Ag2S(s)+2I-(aq) A.A B.B C.C D.D 組卷:16引用:5難度:0.7 -
6.下列實驗操作、現象與結論相匹配的是( )
操作 現象 結論 A 用濕潤的石蕊試紙檢驗甲烷與氯氣在光照下反應后的有機產物 試紙變紅 生成的有機物具有酸性 B 常溫下,用pH計分別測定等體積
1mol?L?1CH3COONH4溶液和0.1mol?L?1CH3COONH4溶液的pH測得pH都等于7 同溫下,不同濃度的CH3COONH4溶液中水的電離程度相同 C 常溫下,將50mL苯與50mLCH3COOH混合 所得混合溶液的體積為101mL 混合過程中削弱了CH3COOH分子間的氫鍵,且苯與CH3COOH分子間的作用弱于氫鍵 D 將苯、液溴、鐵粉混合后產生的氣體通入AgNO3溶液中 產生淡黃色沉淀 苯與液溴發生了取代反應 A.A B.B C.C D.D 組卷:10引用:1難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.超酸是一類比純硫酸更強的酸。某興趣小組的同學對超酸HSbF6的制備及性質進行了探究。制備HSbF6的初始實驗裝置如圖,夾持、加熱及攪拌裝置略。
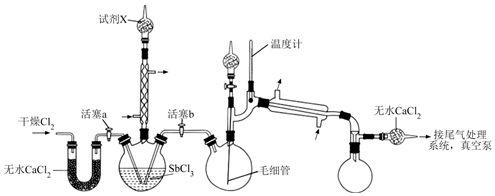
已知:①制備HSbF6的反應為SbCl3+Cl2SbCl5,SbCl5+6HF=HSbF6+5HCl。80℃
②有關物質的性質如表。
回答下列問題:物質 熔點 沸點 性質 SbCl3 73.4℃ 223.5℃ 極易水解 SbCl5 2.8℃ 140℃分解,79℃/2.9kPa 極易水解
(1)KMnO4和濃鹽酸制取Cl2的離子方程式為。
(2)實驗裝置中,兩個冷凝管(填“能”或“不能”)交換使用。毛細管的作用是。
(3)試劑X的成分是(填化學名稱);若無盛試劑X的裝置,SbCl3可能發生水解生成Sb2O3,其水解反應的化學方程式為。
(4)用真空泵抽氣將SbCl5轉移至雙口燒瓶前,必須關閉的活塞是(填“a”或“b”),再減壓蒸餾而不是常壓蒸餾的主要原因是。
(5)由SbCl5制備HSbF6時,應選用材質的儀器。(填標號)
A.玻璃
B.陶瓷
C.鐵或鋁
D.聚四氟乙烯
(6)為更好地理解超酸的強酸性,該小組的同學查閱相關資料了解到:弱酸在強酸性溶劑中表現出堿的性質,如冰醋酸與純硫酸反應:CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-,以此類推,H2SO4與HSbF6反應的化學方程式為。組卷:23引用:1難度:0.5 -
19.丁二烯是生產合成橡膠的主要原料。一定條件下,2,3-二甲基-1,3-丁二烯(
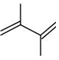 )與溴單質發生液相加成反應(1,2加成和1,4加成),已知溶劑極性越大越容易發生1,4加成。現體系中同時存在如下反應:
)與溴單質發生液相加成反應(1,2加成和1,4加成),已知溶劑極性越大越容易發生1,4加成。現體系中同時存在如下反應: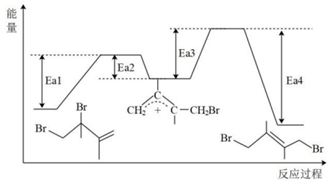
①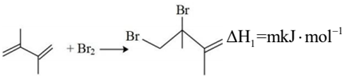
②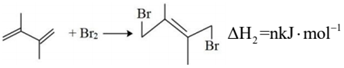
③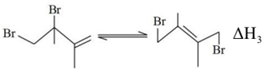
由阿倫尼烏斯公式推知,同一反應在不同溫度(T)下,反應速率常數(k)與活化能(Ea)的關系如下:(其中R為常數)。已知體系中兩種產物可通過中間產物lgk2k1=Ea2.303R(1T1-1T2)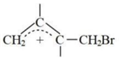 互相轉化,反應歷程及能量變化如上圖所示:
互相轉化,反應歷程及能量變化如上圖所示:
(1)由反應歷程及能量變化圖示判斷,mn(填“>”、“=”或“<”),ΔH3=。(用含不同活化能Ea的式子表示)
(2)其他條件不變的情況下,由公式(R為常數)推測:升高一定溫度,活化能越大,速率常數增大倍數lgK2K1=-Ea2.303R(1T2-1T1)(填“越大”“越小”或“不變”)。對反應(填①或②)的速率提高更有利。
(3)由反應歷程及能量變化圖示判斷,產物中(用系統命名法命名)含量更大,若要提高該產物在平衡體系中的物質的量分數,還可采取的措施是。
(4)在一定溫度下,向某反應容器中加入1.0mol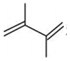 和一定量的Br2發生上述反應。測得
和一定量的Br2發生上述反應。測得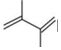 的平衡轉化率為α,平衡時Br2為bmol,若以物質的量分數表示的平衡常數Kx,反應③的平衡常數Kx3=3(以物質的量分數表示的平衡常數),則產物
的平衡轉化率為α,平衡時Br2為bmol,若以物質的量分數表示的平衡常數Kx,反應③的平衡常數Kx3=3(以物質的量分數表示的平衡常數),則產物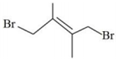 的選擇性為 (已知選擇性指生成目標產物所消耗的原料量在全部所消耗原料量中所占的比例),開始加入的Br2為mol,反應①的平衡常數Kx1=。組卷:33引用:2難度:0.6
的選擇性為 (已知選擇性指生成目標產物所消耗的原料量在全部所消耗原料量中所占的比例),開始加入的Br2為mol,反應①的平衡常數Kx1=。組卷:33引用:2難度:0.6


