2020-2021學年廣東實驗中學高二(上)月考化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(本題包括10個小題,每小題5分,共50分)
-
1.下列關于熱化學反應的描述中正確的是( )
A.HCl和NaOH反應的中和熱ΔH=-57.3kJ?mol-1,則H2SO4和Ba(OH)2反應的中和熱ΔH=2×(-57.3)kJ?mol-1 B.CO(g)的燃燒熱是283.0kJ?mol-1則2CO2(g)=2CO(g)+O2(g)反應的ΔH=+(2×283.0)kJ/mol C.已知石墨比金剛石更穩定,則可知C(石墨)=C(金剛石),ΔH<0 D.一定的溫度和一定的壓強下,將0.5molN2和1.5molH2置于密閉容器中充分反應,放熱19.3kJ,熱化學方程式為N2(g)+3H2(g)?2NH3(g) ΔH=-38.6kJ?mol-1 組卷:13引用:1難度:0.8 -
2.中和熱測定實驗中,用50mL0.50mol/L鹽酸和50mL0.55mol/LNaOH溶液進行實驗,下列說法不正確的是( )
A.用量筒量取鹽酸時仰視取液,測得的中和熱△H偏小 B.裝置中的大小燒杯之間填滿碎泡沫塑料的作用是保溫隔熱減少熱量損失 C.酸堿混合時,量筒中NaOH溶液應緩緩倒入小燒杯中,不斷用玻璃棒攪拌 D.改用25mL0.50mol/L鹽酸跟25mL0.55mol/LNaOH溶液進行反應,求出的中和熱△H和原來相同 組卷:80引用:2難度:0.4 -
3.汽車尾氣無害化處理時發生反應2NO(g)+2CO(g)?N2(g)+2CO2(g),且降溫反應物的轉化率增大。下列說法正確的是( )
A.該反應△H>0 B.降低溫度轉化率增大,是因為正反應速率增大,逆反應速率減小 C.增大壓強,可以使NO和CO完全轉化為無污染的N2和CO2而消除污染 D.升高溫度,該反應的平衡常數K將減小 組卷:17引用:2難度:0.5 -
4.一定溫度時,向2.0L恒容密閉容器中充入2mol SO2和1mol O2,發生反應:2SO2(g)+O2(g)?2SO3(g)。經過一段時間后達到平衡。反應過程中測定的部分數據見表,下列說法正確的是( )
t/s 0 2 4 6 8 n(SO3)/mol 0 0.8 1.4 1.8 1.8 A.反應在前2s的平均速率v(O2)=0.4mol?L-1?s-1 B.保持其他條件不變,體積壓縮到1.0L,平衡向逆反應方向移動 C.在該條件下達到平衡后繼續反應一段時間,SO2的轉化率大于90% D.保持溫度不變,向該容器中再充入2mol SO2、1mol O2,反應達到新平衡時 增大n(SO3)n(O2)組卷:37引用:2難度:0.5
二、填空題(11題14分,12題16分,13題20分,共50分)
-
12.為有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物、碳氧化物含量顯得尤為重要。
(1)NOX是汽車尾氣中的主要污染物之一,汽車發動機工作時會引發N2和O2反應,其能量變化如圖1所示: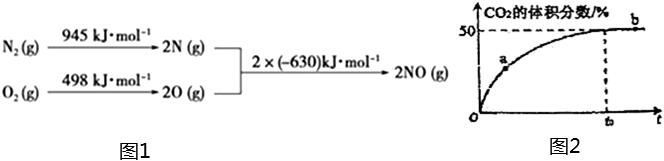
寫出該反應的熱化學方程式:。
(2)汽車在行駛過程中會產生有害氣體CO、NO,在催化劑作用下發生如下脫硝反應:2NO(g)+2CO(g)=2CO2(g)+N2(g),該反應平衡常數的表達式K=,在570K時,K值極大,為1.0×1059,但汽車上仍需裝備尾氣處理裝置,其可能原因是。
(3)以Mn3O4為上述脫硝反應的催化劑,研究者提出如下反應歷程,將歷程補充完整.
第一步:;
第二步:3MnO2+2CO=Mn3O4+2CO2
(4)T℃、2L密閉容器中,充入各1mol的CO和NO混合氣體,加入Mn3O4發生脫硝反應,t0時達到平衡,測得反應過程中CO2的體積分數與時間的關系如圖2所示:
①比較大小:a處v(正)b處v(逆)(填“>”、“<”或“=”)。
②若t0=10min,反應從開始到達平衡CO氣體的平均反應速率υ(CO)=。
③NO的平衡轉化率為,T℃時反應的化學平衡常數K=。組卷:1引用:1難度:0.5 -
13.甲醇是一種重要的有機原料,在催化劑的作用下,CO和H2反應可生成甲醇(CH3OH)和副產物CH4,反應如下:
反應①CO(g)+2H2(g)?CH3OH(g) ΔH1=-90.0kJ/mol
反應②CO(g)+3H2(g)?CH4(g)+H2O(g) ΔH2
反應③CH4(g)+2H2O(g)?CO2(g)+4H2(g) ΔH3=+125.0kJ/mol
反應④CO(g)+H2O(g)?CO2(g)+H2(g) ΔH4=-25.0kJ/mol K1、K2、K3、K4分別表示反應①、②、③、④的平衡常數.
回答下列問題:
(1)反應②的ΔH2=kJ/mol,K2與K3和K4的關系為K2=。
(2)圖1中能正確表示反應①的平衡常數(lgK1)隨溫度變化的曲線為(填曲線字母),其判斷理由為。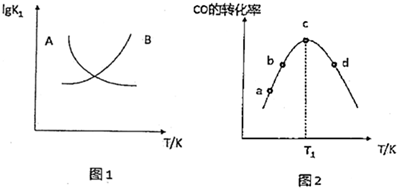
(3)為探究不同催化劑對CO和H2生成CH3OH的選擇性效果,某實驗室控制CO和H2的初始投料比為1:3進行實驗,得到如下表1數據:
①由表1可知,反應Ⅰ的最佳催化劑為T/K 時間/min 催化劑種類 甲醇的含量(%) 450 10 CuO-ZnO 78 450 10 CuO-ZnO-ZrO2 88 450 10 ZnO-ZrO2 46 。
②圖2中,T1℃時CO轉化率最大的原因是。
③有利于提高CO轉化為CH3OH的平衡轉化率的措施有。
A.使用催化劑CuO-ZnO-ZrO2
B.適當降低反應溫度
C.增大CO和H2的初始投料比
D.恒容下,再充入amolCO和3amolH2
(4)已知1000℃,反應CO(g)+H2O(g)?CO2(g)+H2(g) K4=1.0,該溫度下,在某時刻體系中CO、H2O、CO2、H2的濃度分別為3mol?L-1、1mol?L-1、4mol?L-1、2mol?L-1,則此時上述反應的v正(CO)v逆(CO)(填“>”、“<”或“=”),達到平衡時c(CO)=mol?L-1。組卷:1引用:1難度:0.5


