蘇教版高三(上)高考題同步試卷:1.2 化學(xué)能與電能的轉(zhuǎn)化(01)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共20小題)
-
1.燃料電池能有效提高能源利用率,具有廣泛的應(yīng)用前景。下列物質(zhì)均可用作燃料電池的燃料,其中最環(huán)保的是( )
A.甲醇 B.天然氣 C.液化石油氣 D.氫氣 組卷:513引用:42難度:0.9 -
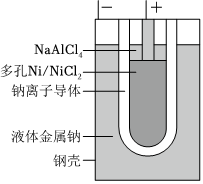 2.“ZEBRA”蓄電池的結(jié)構(gòu)如圖所示,電極材料多孔Ni/NiCl2和金屬鈉之間由鈉離子導(dǎo)體制作的陶瓷管相隔。下列關(guān)于該電池的敘述錯(cuò)誤的是( )
2.“ZEBRA”蓄電池的結(jié)構(gòu)如圖所示,電極材料多孔Ni/NiCl2和金屬鈉之間由鈉離子導(dǎo)體制作的陶瓷管相隔。下列關(guān)于該電池的敘述錯(cuò)誤的是( )A.電池反應(yīng)中有NaCl生成 B.電池的總反應(yīng)是金屬鈉還原三價(jià)鋁離子 C.正極反應(yīng)為:NiCl2+2e-═Ni+2Cl- D.鈉離子通過(guò)鈉離子導(dǎo)體在兩電極間移動(dòng) 組卷:1515引用:18難度:0.9 -
3.銀制器皿日久表面會(huì)逐漸變黑,這是生成了Ag2S的緣故.根據(jù)電化學(xué)原理可進(jìn)行如下處理:在鋁質(zhì)容器中加入食鹽溶液,再將變黑的銀器浸入該溶液中,一段時(shí)間后發(fā)現(xiàn)黑色會(huì)褪去.下列說(shuō)法正確的是( )
A.處理過(guò)程中銀器一直保持恒重 B.銀器為正極,Ag2S被還原生成單質(zhì)銀 C.該過(guò)程中總反應(yīng)為2Al+3Ag2S═6Ag+Al2S3 D.黑色褪去的原因是黑色Ag2S轉(zhuǎn)化為白色AgCl 組卷:3028引用:44難度:0.9 -
4.某同學(xué)組裝了如圖所示的電化學(xué)裝置,電極Ⅰ為Al,其它均為Cu,則( )
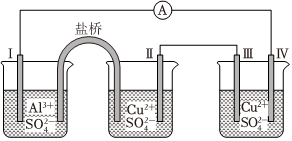
A.電流方向:電極Ⅳ→A→電極Ⅰ B.電極Ⅰ發(fā)生還原反應(yīng) C.電極Ⅱ逐漸溶解 D.電極Ⅲ的電極反應(yīng):Cu2++2e-═Cu 組卷:2998引用:63難度:0.7 -
5.下列說(shuō)法不正確的是( )
A.多孔碳可用作氫氧燃料電池的電極材料 B.pH計(jì)不能用于酸堿中和滴定終點(diǎn)的判斷 C.科學(xué)家發(fā)現(xiàn)一種新細(xì)菌的DNA鏈中有砷(As)元素,該As元素最有可能取代了普通DNA鏈中的P元素 D. 和CO2反應(yīng)生成可降解聚合物
,反應(yīng)符合綠色化學(xué)的原則
組卷:579引用:15難度:0.9 -
6.將分別盛有熔融的氯化鉀、氯化鎂、氧化鋁的三個(gè)電解槽串聯(lián),在一定條件下通電一段時(shí)間后,析出鉀、鎂、鋁的物質(zhì)的量之比為( )
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2 組卷:1290引用:78難度:0.7 -
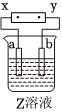 7.如圖中x、y分別是直流電源的兩極,通電后發(fā)現(xiàn)a極板質(zhì)量增加,b極板處有無(wú)色無(wú)臭氣體放出,符合這一情況的是( )
7.如圖中x、y分別是直流電源的兩極,通電后發(fā)現(xiàn)a極板質(zhì)量增加,b極板處有無(wú)色無(wú)臭氣體放出,符合這一情況的是( ) a極板 b極板 X電極 電解質(zhì)溶液 A 鋅 石墨 負(fù)極 CuSO4 B 石墨 石墨 負(fù)極 NaOH C 銀 鐵 正極 AgNO3 D 銅 石墨 負(fù)極 CuCl2 A.A B.B C.C D.D 組卷:1000引用:51難度:0.7
二、解答題(共3小題)
-
22.氫能是最重要的新能源.儲(chǔ)氫作為氫能利用的關(guān)鍵技術(shù),是當(dāng)前關(guān)注的熱點(diǎn)之一.
(1)氫氣是清潔能源,其燃燒產(chǎn)物為.
(2)NaBH4是一種重要的儲(chǔ)氫載體,能與水反應(yīng)生成NaBO2,且反應(yīng)前后B的化合價(jià)不變,該反應(yīng)的化學(xué)方程式為,反應(yīng)消耗1mol NaBH4時(shí)轉(zhuǎn)移的電子數(shù)目為.
(3)儲(chǔ)氫還可借助有機(jī)物,如利用環(huán)己烷和苯之間的可逆反應(yīng)來(lái)實(shí)現(xiàn)脫氫和加氫. (g)Pt-Sn/Al2O3高溫
(g)Pt-Sn/Al2O3高溫 (g)+3H2(g)
(g)+3H2(g)
在某溫度下,向恒容密閉容器中加入環(huán)己烷,其起始濃度為amol?L-1,平衡時(shí)苯的濃度為bmol?L-1,該反應(yīng)的平衡常數(shù)K=
(4)一定條件下,如圖所示裝置可實(shí)現(xiàn)有機(jī)物的電化學(xué)儲(chǔ)氫(忽略其它有機(jī)物).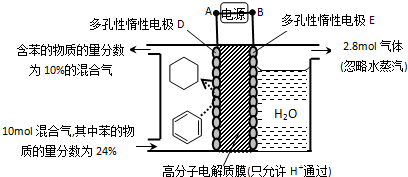
①導(dǎo)線中電子轉(zhuǎn)移方向?yàn)?!--BA-->.(用A、D表示)
②生成目標(biāo)產(chǎn)物的電極反應(yīng)式為.
③該儲(chǔ)氫裝置的電流效率η=.(η=×100%,計(jì)算結(jié)果保留小數(shù)點(diǎn)后1位.)生成目標(biāo)產(chǎn)物消耗的電子數(shù)轉(zhuǎn)移的電子總數(shù)組卷:1468引用:24難度:0.5 -
 23.化學(xué)在環(huán)境保護(hù)中起著十分重要的作用,催化反硝化法和電化學(xué)降解法可用于治理水中硝酸鹽的污染。
23.化學(xué)在環(huán)境保護(hù)中起著十分重要的作用,催化反硝化法和電化學(xué)降解法可用于治理水中硝酸鹽的污染。
(1)催化反硝化法中,H2能將還原為N2.25℃時(shí),反應(yīng)進(jìn)行10min,溶液的pH由7變?yōu)?2。NO-3
①N2的結(jié)構(gòu)式為。
②上述反應(yīng)的離子方程式為,其平均反應(yīng)速率υ()為NO-3mol?L-1?min-1。
③還原過(guò)程中可生成中間產(chǎn)物,寫(xiě)出3種促進(jìn)NO-2水解的方法NO-2。
(2)電化學(xué)降解的原理如圖所示。NO-3
①電源正極為(填A(yù)或B),陰極反應(yīng)式為。
②若電解過(guò)程中轉(zhuǎn)移了2mol電子,則膜兩側(cè)電解液的質(zhì)量變化差(Δm左-Δm右)為g。組卷:1286引用:25難度:0.1


