2022-2023學(xué)年湖南省株洲市攸縣一中高三(上)月考化學(xué)試卷(五)
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共14小題,每小題3分,共42分,每小題只有一個選項符合題意。)
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān)。下列有關(guān)說法正確的是( )
A.燃煤脫硫有利于實現(xiàn)“碳達峰、碳中和” B.核酸檢測是確認病毒類型的有效手段,核酸不屬于天然高分子化合物 C.野外被蚊蟲叮咬,可在傷口處涂抹肥皂水來減輕痛癢 D.天然氣、水煤氣、沼氣等不可再生能源,均可設(shè)計成燃料電池實現(xiàn)能量轉(zhuǎn)化 組卷:19引用:2難度:0.7 -
2.NA表示阿伏加德羅常數(shù)的值,下列說法正確的是( )
A.常溫下22.4LNH3含有的中子數(shù)為7NA B.常溫下1LpH=13的Ba(OH)2溶液中OH-的數(shù)目為0.2NA C.將50mL12mol/L鹽酸與足量MnO2共熱,轉(zhuǎn)移的電子數(shù)為0.3NA D.56gC3H6和C4H8的混合氣體中含有的氫原子數(shù)為8NA 組卷:25引用:3難度:0.7 -
3.下列指定反應(yīng)的離子方程式正確的是( )
A.用氨水吸收足量的SO2氣體:2NH3?H2O+SO2=2 +NH+4+H2OSO2-3B.將Cl2通入石灰乳中制漂白粉:Cl2+2OH-=ClO-+Cl-+H2O C.ZnCO3溶于稀鹽酸: +2H+=H2O+CO2↑CO2-3D.向AgBr懸濁液中滴加足量Na2S溶液,出現(xiàn)黑色沉淀:2AgBr(s)+S2-(aq)=Ag2S(s)+2Br-(aq) 組卷:36引用:2難度:0.6 -
4.用反滲透法將海水淡化,剩余的濃縮液(主要含Cl-、Na+、Ca2+、Mg2+、
等離子),可加工獲得其他產(chǎn)品。某學(xué)習(xí)小組模擬工業(yè)生產(chǎn)流程進行實驗。下列說法正確的是( )SO2-4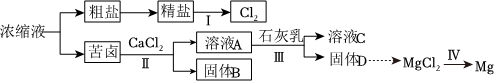
A.反應(yīng)Ⅰ、Ⅱ、Ⅲ、Ⅳ均屬于氧化還原反應(yīng) B.反應(yīng)Ⅲ的離子方程式為Mg2++2OH═Mg(OH)2↓ C.反應(yīng)Ⅱ加入適量CaCl2固體可以獲得CaSO4 D.粗鹽提純中,加入試劑的順序依次為Na2CO3、BaCl2、NaOH、鹽酸 組卷:19引用:2難度:0.7 -
5.W、X、Y、Z、M是構(gòu)成下圖所示離子液體的五種短周期元素,原子序數(shù)依次增大且只有一種元素與其他元素不在同一周期。下列有關(guān)說法不正確的是( )

A.H3XO3為一元弱酸 B.Y的氫化物一定比Z的氫化物沸點低 C.Z的最高價含氧酸在一定條件下能與Y單質(zhì)反應(yīng) D.由W、Z、M元素形成的離子晶體中可能含有正四面體結(jié)構(gòu)的陽離子 組卷:24引用:2難度:0.6 -
6.下列裝置能達到實驗?zāi)康牡氖牵ā 。?br />
A B C D 
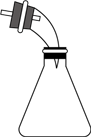
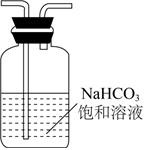
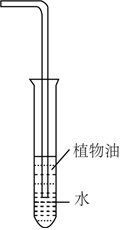 +
+實驗室制氨氣 蒸餾時的接收裝置 除去CO2中少量HCl 吸收多余的HCl氣體 A.A B.B C.C D.D 組卷:27引用:1難度:0.6
二、非選擇題(本題共4小題,共58分。)
-
17.我國對世界鄭重承諾:2030年前實現(xiàn)碳達峰,2060年前實現(xiàn)碳中和。而研發(fā)二氧化碳的碳捕集和碳利用技術(shù)則是關(guān)鍵,其中催化轉(zhuǎn)化法最具應(yīng)用價值.回答下列問題:
Ⅰ.一定溫度下,CO2和H2在催化劑作用下可發(fā)生兩個平行反應(yīng),分別生成CH3OH和CO。
a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH1=-49.5kJ?mol-1
b:CO2(g)+H2(g)?CO(g)+H2O(g) ΔH2=+41.2kJ?mol-1
(1)相同溫度下,CO2(g)+2H2(g)?CH3OH(g) ΔH3=。
(2)在傳統(tǒng)的催化固定反應(yīng)床(CFBR)中,CO2轉(zhuǎn)化率和甲醇選擇性通常都比較低,科學(xué)團隊研制了一種具有反應(yīng)和分離雙功能的分子篩膜催化反應(yīng)器(CMR),極大地改善了該問題,原理如圖所示。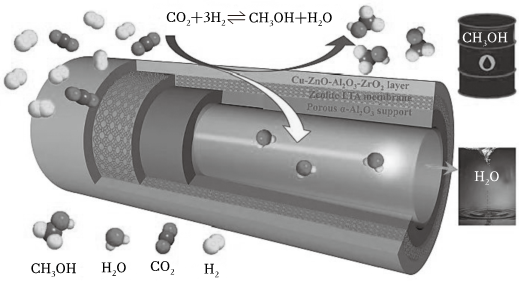
保持壓強為3MPa,溫度為260℃,向密閉容器中投料比按=3投入一定量CO2和H2,不同反應(yīng)模式下CO2的平衡轉(zhuǎn)化率和甲醇選擇性的相關(guān)實驗數(shù)據(jù)如下表所示。n(H2)n(CO2)
已知CH3OH選擇性:轉(zhuǎn)化的CO2中生成CH3OH的百分比。實驗組 反應(yīng)模式 n(H2)n(CO2)溫度/℃ CO2轉(zhuǎn)化率 CH3OH選擇性 ① CFBR 3 260 21.9 67.3 ② CMR 3 260 36.1 100.0
①CMR模式時,上述條件下發(fā)生反應(yīng),下列說法能作為反應(yīng)a達到平衡狀態(tài)的判據(jù)是(填選項字母)。
A.氣體壓強不再變化
B.氣體平均相對分子質(zhì)量不再變化
C.不再變化n(H2)n(CO2)
D.CO2、H2、CH3OH、H2O的物質(zhì)的量之比為1:3:1:1
②由表中數(shù)據(jù)可知CMR模式下,CO2的轉(zhuǎn)化率明顯提高,結(jié)合具體反應(yīng)分析可能的原因:。
(3)反應(yīng)b在進氣比[n(CO2):n(H2)]不同時,測得相應(yīng)的CO2平衡轉(zhuǎn)化率見圖(各點對應(yīng)的反應(yīng)溫度可能相同,也可能不同:其他反應(yīng)條件都相同)。
①A和E兩點對應(yīng)的溫度關(guān)系:T(D)T(F)(填<,>,或=),其原因是。
②已知反應(yīng)速率v正=k正x(CO2)x(H2),v逆=k逆x(CO)x(H2O),k為反應(yīng)速率常數(shù),x為物質(zhì)的量分數(shù),在達到平衡狀態(tài)為G點的反應(yīng)過程(此過程為恒溫)中,當(dāng)CO2的轉(zhuǎn)化率剛好達到20%時,=v正v逆。
Ⅱ.用圖裝置電解二氧化碳也可制取甲醇,控制在一定溫度左右,持續(xù)通入二氧化碳,電解過程中物質(zhì)的量基本不變。HCO-3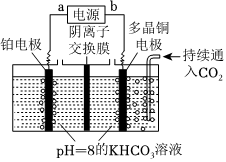
陰極電極反應(yīng)式為:。組卷:38引用:3難度:0.6 -
18.洛哌丁胺(I)可用于腹瀉的治療,其一種合成路線如圖:
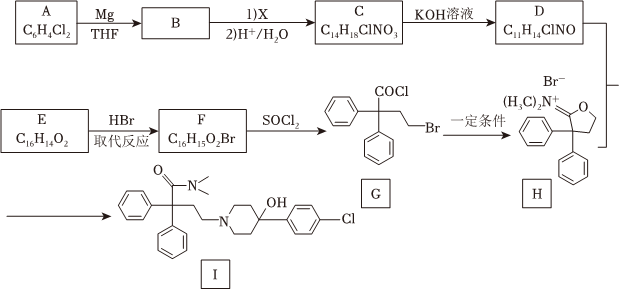
已知:①C反應(yīng)生成D的同時生成碳酸鉀和一種常見的醇
②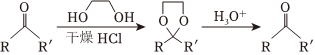
③有關(guān)格氏試劑的反應(yīng):XR-MgX(X代表鹵素原子,下同)MgTHF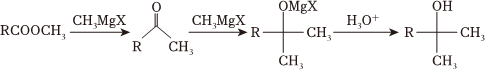
(1)下列說法正確的是。
A.1molI最多與2molNaOH反應(yīng)
B.F中的含氧官能團為羧基
C.H中含有1個手性碳原子
D.B→C包含了加成反應(yīng)和取代反應(yīng)
(2)A的結(jié)構(gòu)簡式為,E的結(jié)構(gòu)簡式為,F(xiàn)的結(jié)構(gòu)簡式為。
(3)補充完整C→D的化學(xué)方程式 C+2KOH→。
(4)寫出符合下列條件的X的兩種同分異構(gòu)體。
①含有一個六元環(huán),無其他環(huán)狀結(jié)構(gòu)
②核磁共振氫譜為3組峰
(5)已知羥基能與格氏試劑發(fā)生反應(yīng)。寫出以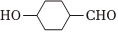 、CH3OH、
、CH3OH、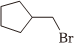 和乙二醇為原料制備
和乙二醇為原料制備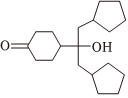 的合成路線(其他試劑任選) 。組卷:33引用:2難度:0.3
的合成路線(其他試劑任選) 。組卷:33引用:2難度:0.3


