《第2章 分子結構與性質》2012年單元測試卷(長白山一中)
發布:2024/4/20 14:35:0
一、選擇題(本題包括16小題,每小題3分,共48分,每小題只有一個正確答案)
-
1.下列化學鍵中,鍵的極性最強的是( )
A.C-F B.C-O C.C-N D.C-C 組卷:256引用:11難度:0.9 -
2.已知短周期元素的離子aW3+、bX+、cY2-、dZ-具有相同的電子層結構,下列關系正確的是( )
A.質子數c>b B.原子半徑X<W C.氫化物的穩定性H2Y>HZ D.離子的還原性Y2->Z- 組卷:130引用:175難度:0.5 -
3.下列結構圖中,●代表前二周期元素的原子實(原子實是原子除去最外層電子后剩余的部分),小黑點代表未用于形成共價鍵的最外層電子,短線代表價鍵.示例:根據各圖表示的結構特點,下列有關敘述正確的是( )
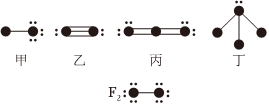
A.上述結構圖中共出現6種元素 B.甲、乙、丙為非極性分子,丁為極性分子 C.甲與丁可以發生化合反應生成離子化合物 D.向CaCl2溶液中加入(或通入)丙有白色沉淀產生 組卷:49引用:8難度:0.7 -
4.根據科學人員探測,在海洋深處的沉積物中含有可燃冰,主要成分是甲烷水合物.有關其組成的兩種分子的下列說法正確的是( )
A.它們都是極性鍵構成的極性分子 B.它們之間以氫鍵結合在一起 C.它們的成鍵電子的原子軌道都是sp3-S D.它們的立體結構都相同 組卷:28引用:3難度:0.9 -
5.下列說法正確的是( )
A.一個水分子與其他水分子間只能形成2個氫鍵 B.含氫鍵的分子熔、沸點一定升高 C.分子間作用力包括氫鍵和范德華力 D.當H2O由液體變為氣體時只破壞了氫鍵 組卷:122引用:2難度:0.5 -
6.碘單質在水溶液中溶解度很小,但在CCl4中溶解度很大,這是因為( )
A.CCl4與I2分子量相差較小,而H2O與I2分子量相差較大 B.CCl4與I2都是直線型分子,而H2O不是直線型分子 C.CCl4和I2都不含氫元素,而H2O中含有氫元素 D.CCl4和I2都是非極性分子,而H2O是極性分子 組卷:284引用:46難度:0.7 -
7.韓國首爾大學的科學家將水置于一個足夠強的電場中,在20℃時,水分子瞬間凝固形成“暖冰”.下列關于“暖冰”的說法正確的是( )
A.暖冰中水分子是直線型分子 B.水凝固形成20℃時的“暖冰”所發生的變化是化學變化 C.暖冰中水分子的各原子均滿足8電子穩定結構 D.在電場作用下,水分子間更易形成氫鍵,因而可以制得“暖冰” 組卷:46引用:12難度:0.7
二、填空題(本題共6小題)
-
21.已知A、B、C、D四種分子所含原子的數目依次為1、3、6、6,且都含有18個電子,B、C是由兩種元素的原子組成,且分子中兩種原子的個數比均為1:2.D是一種有毒的有機物.
(1)組成A分子的原子的元素符號是;
(2)從B分子的立體構型判斷,該分子屬于(填“極性”或“非極性”)分子;
(3)C分子中包含個σ鍵,個π鍵.
(4)D的熔、沸點比CH4的熔、沸點高,其主要原因是(須指明D是何物質):.組卷:68引用:2難度:0.5 -
22.圖1是元素周期表的前三周期,回答下列問題:
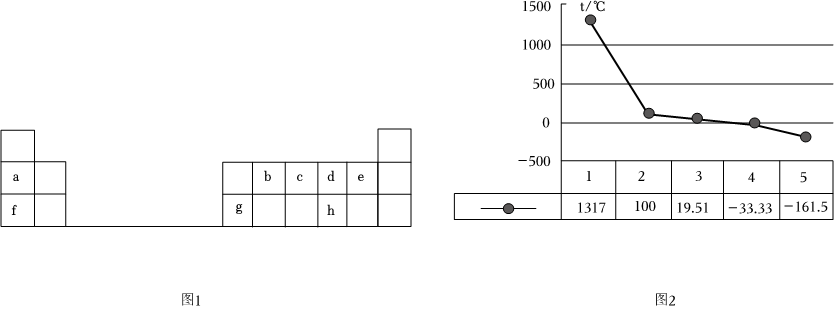
(1)g的單質能與f元素的最高價氧化物對應水化物的溶液反應,請寫出該反應的離子方程式.
(2)a、b、c、d、e的氫化物的沸點直角坐標圖如圖2所示,序號“5”的氫化物的化學式為,并用雜化軌道理論解釋該分子在空間的立體構型.
(3)電子排布式為[Ne]3s23p4的元素名稱為,其氫化物的立體構型為,并用價層電子對互斥理論模型解釋該分子在空間的立體構型.組卷:21引用:2難度:0.5


