2021-2022學年福建師大附中高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題包括22小題,每小題2分,共44分.每小題只有一個選項符合題意.
-
1.氫能是一種既高效又干凈的新能源,發展前景良好,用氫作能源的燃料電池汽車備受青睞.我國擁有完全自主知識產權的氫燃料電池轎車“超越三號”,已達到世界先進水平,并加快向產業化的目標邁進.氫能具有的優點包括( )
①原料來源廣 ②易燃燒、熱值高 ③儲存方便 ④制備工藝廉價易行.A.①② B.①③ C.③④ D.②④ 組卷:114引用:36難度:0.9 -
2.下列化學用語表達不正確的是( )
A.銨根的電子式: 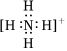
B.N2的結構式:N≡N C.NH3分子的球棍模型: 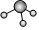
D.H2S的電子式: 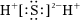 組卷:9引用:2難度:0.9
組卷:9引用:2難度:0.9 -
3.下列關于氮氣的說法中正確的是( )
A.通常情況下氮氣性質很穩定,所以氮氣可以在電焊時作保護氣 B.N2+3H2 2NH3該反應用于工業合成氨高溫C.氮氣在空氣中約占質量比的 45D.在反應3Mg+N2 Mg3N2中,氮氣作還原劑高溫組卷:79引用:2難度:0.8 -
4.下列有關說法正確的是( )
A.二氧化硅和干冰都屬于共價晶體 B.C60和C70是具有相同質子數的不同核素 C.冰和氧化鈉熔化時克服相同類型的化學鍵 D.H2NCH2COOH和CH3CH2NO2互為同分異構體 組卷:33引用:2難度:0.8 -
5.下列因發生氧化還原反應而不能大量共存的離子組是( )
A.Na+、Ba2+、HCO3-、SO42- B.Na+、K+、Cl-、OH- C.Fe2+、Na+、NO3-、H+ D.NH4+、K+、OH-、Cl- 組卷:21引用:2難度:0.7 -
6.能量通常包括熱能、電能、光能、機械能、化學能等,下列有關能量轉化關系的判斷錯誤的是( )
A.充電電池:電能轉化為化學能 B.干電池:化學能轉化為電能 C.木炭燃燒:化學能轉化為熱能和光能 D.風力發電:風能轉化為機械能,機械能轉化為電能 組卷:12引用:3難度:0.8 -
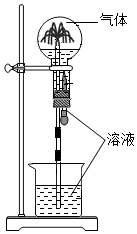 7.噴泉實驗裝置如圖所示,應用下列各組氣體-溶液,能出現噴泉現象的是( )
7.噴泉實驗裝置如圖所示,應用下列各組氣體-溶液,能出現噴泉現象的是( )A.H2S-稀鹽酸 B.HCl-稀氨水 C.NO-稀H2SO4 D.CO2-飽和NaHCO3溶液 組卷:95引用:2難度:0.7 -
8.下列事實不能用元素周期律解釋的是( )
A.堿性:Mg(OH)2>Be(OH)2 B.熱穩定性:Na2CO3>NaHCO3 C.酸性:HClO4>H2SO4 D.氣態氫化物的穩定性:NH3>PH3 組卷:40引用:2難度:0.7 -
9.如圖,在盛有稀硫酸的燒杯中放入用導線連接的電極X、Y,觀察到Y電極上有氣泡產生。關于該裝置的下列說法正確的是( )

A.電子流動方向為X→外電路→Y→稀硫酸→X B.該裝置中X為正極,Y電極上發生氧化反應 C.溶液中 向X電極方向移動SO2-4D.若兩電極都是金屬,則它們的活動性順序為X<Y 組卷:56引用:3難度:0.5
二、填空題:本題包括4小題,共56分.
-
26.某興趣小組通過實驗制備Fe(NO3)3并進行性質探究.
(1)HNO3的制備:利用如圖裝置,模擬氨的催化氧化法制備硝酸.其中,甲為氨氣的發生裝置.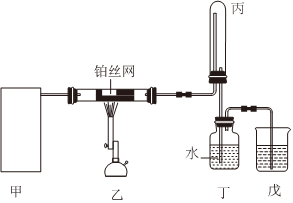
①若選用一種試劑制取氨氣,則該試劑為(選填試劑名稱),此時,甲中空白處所需裝置應為(填標號).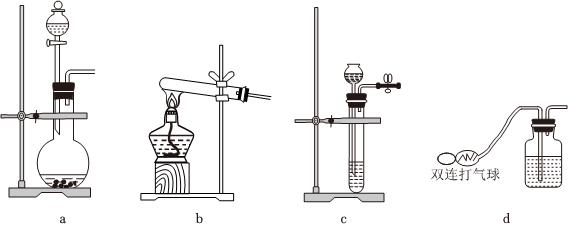
②寫出裝置乙中生成NO氣體的化學方程式.
③實驗結束后從戊中取出少量液體于試管中,滴入紫色石蕊試液,當觀察到溶液變紅時,說明已制得了硝酸.若裝置丁中產生了大量的白煙,其成分是(填化學式).
④取一定量的硝酸加水稀釋到50mL,加入過量的銅充分反應,再向溶液中加入足量的稀硫酸,最終共收集到6.72L(標況)NO、NO2的混合氣體(不考慮N2O4),銅仍有剩余,將氣體充入0.125molO2并倒扣于水槽中,水剛好充滿整支試管,則原稀釋后的硝酸的物質的量濃度是mol/L,反應溶解的銅有g.
(2)Fe(NO3)3溶液的制備:利用硝酸與下列物質反應制備Fe(NO3)3溶液時,最佳選擇為(填標號),其理由是.
A.Fe
B.FeO
C.Fe(OH)2
D.Fe3O4
E.Fe2O3
(3)Fe(NO3)3溶液性質的探究:取適量0.1mol?L-1Fe(NO3)3溶液,加入到新制的銀單質中,發現銀單質溶解,且無其它固體析出.
①實驗任務:通過設計實驗探究Fe(NO3)3溶液溶解銀的原因.
②查閱資料:在不同條件下的還原產物較復雜,有時難以觀察到氣體產生.NO-3
③提出猜想:猜想a:Fe3+具有氧化性,能夠氧化Ag;
猜想b:Fe(NO3)3溶液呈酸性,在此酸性條件下能氧化Ag.NO-3
④設計實驗、驗證猜想
Ⅰ.甲同學從上述實驗的生成物中檢測出Fe2+,驗證了猜想a成立.請寫出Fe3+氧化Ag的離子方程式.
Ⅱ.乙同學設計實驗驗證猜想b,請幫他完成表中內容:實驗步驟(不要求寫具體操作過程) 預期現象和結論 ①
②若銀單質溶解,猜想b成立;若銀單質不溶解,猜想b不成立。 組卷:34引用:1難度:0.5 -
27.現代社會,人類以煤、石油和天然氣(化石燃料)為主要能源.但化石燃料使用過程中存在兩大問題,一方面儲量有限,短期不可再生;另一方面燃燒及使用過程中會產生SO2、NOx、CO等大氣污染物.請回答以下問題:
(1)化石燃料使用過程中產生的含SO2、NOx的廢氣直接排放到大氣中,容易造成酸雨,酸雨是pH小于的降水.
(2)對工業廢氣進行適當處理能夠減少環境污染.其中:
①針對含SO2的工業廢氣可以采用“鈣基固硫法”.例如將生石灰與含硫的煤混合后再燃燒,可以將SO2最終轉化為CaSO4,請寫出該反應化學方程式.
②針對含NOx的工業廢氣可以采用“氨氣催化還原法”,在催化劑、加熱條件下將NOx轉化為無害氣體.請寫出NH3催化還原NO的反應方程式.
(3)通過NO傳感器可監測汽車尾氣中NO的含量,其工作原理如圖所示: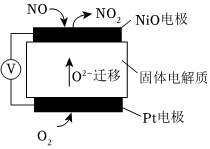
①外電路中,電子流動方向是從電極流向電極(填“NiO”或“Pt”).
②Pt電極上O2+4e-═2O2-,NiO電極上的電極反應式為.
(4)以TiO2為催化劑的光熱化學循環分解CO2反應為溫室氣體減排提供了一個新途徑,該反應的機理及各分子化學鍵完全斷裂時的能量變化如圖所示.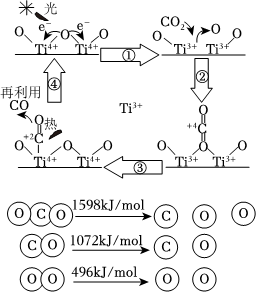
①上述過程中,能量的變化形式是由能轉化為能.
②根據圖中數據,寫出該分解反應的熱化學方程式.組卷:17引用:1難度:0.6


