2022-2023學年遼寧省沈陽五中高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:(本題共15小題,每小題3分,共45分.在每小題給出的四個選項中,只有一項是符合題目要求的。)
-
1.中國詩詞既蘊含人文思想,又煥發理性光輝。對下列詩詞劃線部分的化學解釋不合理的是( )
A.花氣襲人知驟暖,喜鵲穿樹喜新晴--溫度高,分子運動加快 B.千錘萬鑿出深山,烈火焚燒若等閑--煅燒石灰石,為氧化還原變化 C.煙籠寒水月籠沙,夜泊秦淮近酒家--此處的“煙”實為水霧,為一種氣溶膠 D.何意百煉鋼,化為繞指柔--生鐵經不斷煅燒捶打氧化,降低碳的含量,變成鋼 組卷:49引用:5難度:0.8 -
2.下列敘述正確的有( )
①爆炸、變色、導電一定屬于化學變化
②Na2O、Na2O2、CaO都能溶于水生成堿,它們都屬于堿性氧化物
③離子化合物中不一定含有金屬元素
④FeCl2、FeCl3、FeS、Fe(OH)3均可通過化合反應制得
⑤燒堿固體、純醋酸、乙醇均不導電,所以它們都不是電解質
⑥冰中水分子間以氫鍵結合成排列規整的晶體,體積膨脹密度減小,所以冰浮在水面上A.1項 B.2項 C.3項 D.4項 組卷:116引用:3難度:0.8 -
3.下列化學用語正確的是( )
A.硫原子的結構示意圖 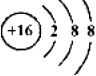
B.Na2O2的電子式為 
C.NaHCO3在水溶液中電離方程式:NaHCO3═Na++H++ CO2-3D.KCl形成過程 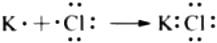 組卷:179引用:6難度:0.8
組卷:179引用:6難度:0.8 -
4.下列關于膠體的敘述正確的是( )
A.將FeCl3溶液滴入沸騰的水中,得到帶正電荷的氫氧化鐵膠體 B.制備的Fe(OH)3膠體能長期穩定存在 C.用激光筆照射NaCl溶液和Fe(OH)3膠體時,產生的現象相同 D.膠體區別于其他分散系的本質特征是分散質粒子的直徑在1nm~100nm之間 組卷:38引用:3難度:0.7 -
5.下列實驗裝置及實驗結果合理的是( )
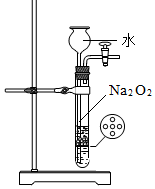
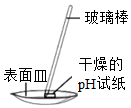
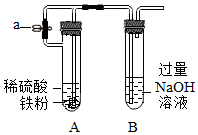
圖1 圖2 圖3 圖4 A.實驗室用圖1所示裝置制備少量氧氣 B.實驗室用圖2所示裝置測定氯水的pH C.實驗室用圖3所示裝置制備少量Fe(OH)2,先打開止水夾a,一段時間后再關閉a D.實驗室用圖4所示裝置證明非金屬性強弱:Cl>C>Si 組卷:1305引用:9難度:0.5 -
6.在兩個容積相同的容器中,一個盛有N2氣體,另一個盛有C2H4和CO的混合氣體。在同溫同壓下,兩容器內的氣體一定相同的物理量有幾項:( )
(1)分子數 (2)原子數 (3)質量 (4)中子數 (5)密度 (6)氣體摩爾體積A.4項 B.5項 C.6項 D.3項 組卷:66引用:3難度:0.7
二、填空題(本題共4小題,共55分)
-
18.新冠肺炎期間,化學消毒劑大顯身手。高鐵酸鉀(K2FeO4,M═198g/mol)是一種高效多功能的綠色消毒劑,廣泛應用于生活用水和廢水的殺菌、消毒。工業制備高鐵酸鉀的方法主要有濕法和干法兩種。
Ⅰ.實驗室模擬濕法制備高鐵酸鉀的流程如圖: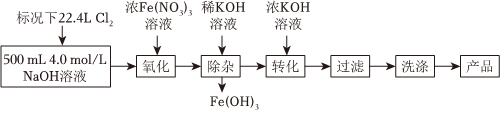
已知:轉化過程發生復分解反應。回答下列問題:
(1)配制上述NaOH溶液,下列操作可能導致溶液濃度偏大的有(填序號)。
A.將NaOH放在濾紙上稱量
B.NaOH在燒杯中溶解后,未經冷卻就立即轉移
C.容量瓶洗凈之后未干燥
D.定容時俯視刻度線
E.搖勻后發現液面低于刻度線,再加水至刻度線
(2)NaOH溶液應置于冰水浴中,否則溫度升高將發生如下副反應:Cl2+NaOH→NaCl+NaClO3+H2O(未配平)。
①若有0.15molCl2發生該副反應,該過程中轉移電子數目為;
②若反應后溶液中NaCl和NaClO3的物質的量之比為6:1,則生成NaCl和NaClO的物質的量之比為。
(3)氧化過程中溶液保持堿性。寫出反應的離子方程式:。
(4)產品經干燥后得到純品99g,則K2FeO4的產率為(用百分數表示)。
Ⅱ.工業干法制備高鐵酸鉀的第一步反應為:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑。
(5)該反應中氧化產物為、,氧化劑和還原劑的物質的量之比為。組卷:37引用:1難度:0.5 -
19.已知NH3和Cl2在常溫下可快速反應生成氮氣:2NH3+3Cl2═N2+6HCl。當NH3過量時,會發生反應NH3+HCl═NH4Cl,產生白煙,因此當Cl2和NH3比例不同時,產物有差異。
(1)若利用該反應處理含有氨氣和氯氣的尾氣,用于制備鹽酸,則Cl2和NH3的最佳比例為。該反應可用于檢驗化工生產中氯氣是否泄漏。若氯氣有少量泄漏,用氨氣檢驗時有明顯現象,此過程中發生反應的Cl2和NH3的體積比范圍為。
(2)體積為1.12L,質量為3.335g的Cl2和N2的混合氣體通過濃氨水后,體積變為0.672L(其中Cl2體積分數為50%)。兩位同學想要根據這些數據計算被氧化的NH3的質量。下面是兩位學生從不同角度解題時所列的第一步算式,請判斷他們所列未知數X分別表示什么量,并填寫在表格內:(單位沒列出)學生編號 所列第一步算式 未知數X表示的意義 甲 ÷X3-12═1.12-0.67222.4乙 3X-0.672÷2═10.672÷2-(1.12-X)組卷:31引用:1難度:0.5


