2021-2022學年安徽省宿州市十三所重點中學高二(上)期末化學試卷(理科)(一)
發布:2024/4/20 14:35:0
一、選擇題(本題共計16小題,每小題只有一個正確答案,每小題3分,共計48分)
-
1.2021年,我國航空航天事業取得了輝煌成就.下列成就所涉及的材料為半導體材料的是( )
A.“天問一號”探測器使用的復合材料——SiC增強鋁基復合材料 B.“天舟三號”貨運飛船使用的質量輕強度高的材料——鋁合金 C.“長征五號”運載火箭使用的高效清潔的液體燃料——液氫 D.“神舟十三號”載人飛船使用的太陽能電池材料——砷化鎵 組卷:41引用:1難度:0.7 -
2.化學與生活密切相關,下列應用原理與鹽類的水解無關的是( )
A.熱的純堿溶液可用于去除餐具上的油污 B.氯化銨溶液可作焊接金屬的除銹劑 C.鹽鹵(主要成分MgCl2)可用于制豆腐 D.泡沫滅火器可用于搶救突發的火災 組卷:12引用:1難度:0.6 -
3.設NA代表阿伏加德羅常數的值,下列敘述錯誤的是( )
A.在100mL0.1mol?L-1Na2CO3溶液中所含陰離子的數目為0.01NA B.在鐵制品上鍍銅時,陰極增重64克,則電路中通過的電子數目為2NA C.在500℃、催化劑作用下,將128gSO2和過量O2置于密閉容器中充分反應:2SO2(g)+O2(g)?2SO3(g),轉移的電子數目小于4NA D.1molCH3COONa與少量CH3COOH溶于水所得的中性溶液中,CH3COO-的數目為NA 組卷:2引用:1難度:0.6 -
4.下列除雜試劑選用正確且除雜過程不涉及氧化還原反應的是( )
物質(括號內為雜質) 除雜試劑 A. FeCl2溶液(FeCl3) Fe粉 B. 工業廢水(Cu2+、Hg2+和Pb2+) FeS固體 C. Cl2(HCl) NaHCO3溶液、濃H2SO4 D. NO(NO2) NaOH溶液、無水CaCl2 A.A B.B C.C D.D 組卷:8引用:1難度:0.5 -
5.在下列各溶液中,一定能大量共存的離子組是( )
A.有色透明溶液中:Fe3+、Ba2+、SCN-、NO3- B.強酸性溶液中:Fe2+、K+、CO32-、NO3- C.含有大量Al3+的溶液中:K+、Na+、HCO3-、Cl- D.常溫下水電離的C平(H+)為1.0×10-12mol?L-1的溶液中:K+、Na+、SO42-、NO3- 組卷:6引用:1難度:0.7 -
6.在0.1mol?L-1NaHCO3溶液中,各種微粒之間存在如下關系,其中不正確的是( )
A.C平(Na+)+C平(H+)═C平(HCO3-)+C平(CO32-)+C平(OH- ) B.C平(Na+)═C平(HCO3-)+C平(CO32-)+C平(H2CO3) C.C平(H+)+C平(H2CO3)═C平(CO32-)+C平(OH- ) D.C平(Na+)>C平(HCO3-)>C平(H2CO3)>C平(CO32-) 組卷:10引用:1難度:0.6
二、填空題(本大題共4小題,共計52分)
-
19.由鈦鐵礦(主要成分是FeTiO3,含有少量Fe2O3、SiO2、Al2O3等雜質),制備TiCl4等產品的一種工藝流程如圖:
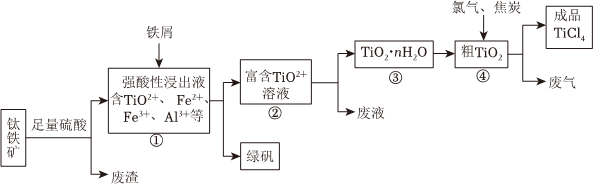
回答下列問題:
(1)用硫酸酸浸時,為使酸浸速率加快,可采取的措施是:(寫1條即可);
(2)廢渣的成分是:(填化學式);
(3)②→③,加水稀釋即可實現,其離子方程式為:;
(4)若將制得的固體TiO2?nH2O用酸清洗除去其中的Fe(OH)3雜質,還可制得鈦白粉。已知25℃時,Kw=1.0×10-14mol2?L-2,Ksp[Fe(OH)3]=4.0×10-38mol4?L-4,該溫度下反應Fe(OH)3+3H+?Fe3++3H2O平衡常數K=。
(5)廢氣主要為有毒氣體,高溫下從TiO2制備TiCl4化學方程式為_。組卷:7引用:2難度:0.5 -
20.焦亞硫酸鈉(Na2S2O5)在醫藥、橡膠、印染、食品等方面應用廣泛。回答下列問題:
(1)生產Na2S2O5,通常是由NaHSO3過飽和溶液經結晶脫水制得。寫出該過程的化學方程式
(2)利用煙道氣中的SO2生產Na2S2O5,的工藝為: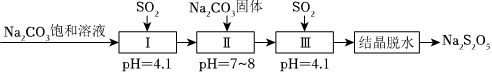
①pH=4.1時,Ⅰ中為溶液(寫化學式)。
②工藝中加入Na2CO3固體,并再次充入SO2的目的是。
(3)制備Na2S2O5也可采用三室膜電解技術,裝置如圖所示,其中SO2堿吸收液中含有NaHSO3和Na2SO3.陽極的電極反應式為。電解后,室的NaHSO3濃度增加。將該室溶液進行結晶脫水,可得到Na2S2O5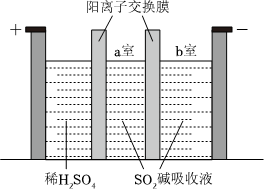
(4)Na2S2O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2O5殘留量時,取50.00mL葡萄酒樣品,用0.01000mol?L-1的碘標準液滴定至終點,消耗10.00mL.滴定反應的離子方程式為該樣品中Na2S2O5的殘留量為g?L-1(以SO2計)組卷:2329引用:8難度:0.5


