2021-2022學年福建省福州市鼓樓區銅盤中學高二(上)月考化學試卷(12月份)
發布:2024/4/20 14:35:0
一、選擇題(本大題共15題,每小題3分,共45分。每小題只有一個選項符合題目要求)
-
1.一定條件下,下列不能用勒夏特列原理解釋的是( )
A.H2、I2、HI混合氣體加壓顏色變深 B.NO2氣體受壓縮顏色先變深后變淺 C.實驗室用排飽和食鹽水的方法收集Cl2 D.合成氨工業采用高壓,以提高原料的利用率 組卷:66引用:2難度:0.7 -
2.關于有效碰撞理論,下列說法不正確的是( )
A.化學反應的實質是活化分子有合適取向時的有效碰撞 B.增大反應物濃度能夠增大活化分子百分數,化學反應速率一定增大 C.升高溫度,活化分子百分數增加,化學反應速率一定增大 D.催化劑能改變反應歷程和活化能,影響化學反應速率 組卷:74引用:2難度:0.6 -
3.下表中物質的分類組合,完全正確的是( )
編號 A B C D 強電解質 KNO3 H2SO4 BaSO4 HClO4 弱電解質 NH3?H2O CaCO3 HClO C2H5OH 非電解質 SO2 Al H2O CH3COOH A.A B.B C.C D.D 組卷:244引用:8難度:0.9 -
4.一定體積的稀鹽酸與過量的鋁條反應,為了減緩反應速率且不影響生成氫氣的總量,可向鹽酸中加入適量的( )
A.NaCl固體 B.CH3COOK溶液 C.Na2CO3溶液 D.CuCl2 溶液 組卷:83引用:4難度:0.6 -
5.已知外電路中,電子由b極流向鋅.有關如圖所示的裝置分析不合理的是( )
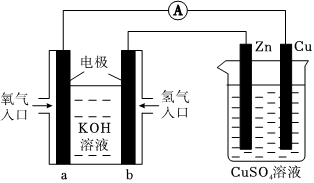
A.該裝置中Cu極為正極 B.當銅極的質量變化為32g時,a極上消耗的O2在標準狀況下的體積為5.6L C.b極反應的電極反應式為H2-2e-+2OH-═2H2O D.一段時間后鋅片一極質量增加 組卷:24引用:4難度:0.5 -
6.對于可逆反應:2A(g)+B(g)?2C(g) ΔH<0,下列圖象正確的是( )
A. 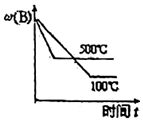
B. 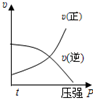
C. 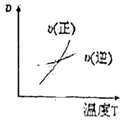
D. 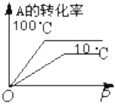 組卷:5引用:3難度:0.7
組卷:5引用:3難度:0.7
二、填空題(共55分)
-
18.課本里介紹的合成氨技術叫哈伯法,是德國諾貝爾化學獎獲得者哈伯發明的。其合成原理為:N2(g)+3H2(g)?2NH3(g) ΔH<0,ΔS<0。
(1)關于工業合成氨的說法不正確的是。
A.因為ΔH<0,所以該反應一定能自發進行
B.因為ΔS<0,所以該反應一定不能自發進行
C.在高溫下進行是為了提高反應物的轉化率
D.使用催化劑加快反應速率是因為催化劑降低了反應的ΔH
(2)在恒溫恒容密閉容器中進行合成氨的反應,下列能說明該反應已達到平衡狀態的是。
a.容器內N2、H2、NH3的濃度之比為1:3:2
b.V正(H2)=V逆(N2)
c.容器內壓強保持不變
d.混合氣體的密度保持不變
(3)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對工業合成氨反應的影響。實驗結果如圖所示(圖中T表示溫度,n表示H2物質的量)。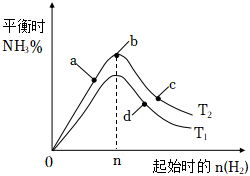
①圖象中T2和T1的關系是:T2T1(填“>,<或=”,下同)
②a、b、c、d四點所處的平衡狀態中,反應物N2的轉化率最高的是(填字母)。
(4)恒溫下,往一個4L的密閉容器中充入5.2molH2和2molN2,反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
①此條件下該反應的化學平衡常數K=時間/min 5 10 15 20 25 30 c(NH3)/mol?L-1 0.08 0.14 0.18 0.20 0.20 0.20 。
②若維持容器體積不變,溫度不變,往原平衡體系中加入H2、N2和NH3各4mol,化學平衡將向反應方向移動(填“正”或“逆”)。組卷:11引用:1難度:0.4 -
19.已知化學反應①:
Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常數為K1;化學反應②:
Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常數為K2.在溫度973K和1173K情況下,K1、K2的值分別如下:
(1)通過表格中的數值可以推斷:反應①是溫度 K1 K2 973K 1.47 2.38 1173 2.15 1.67 (填“吸熱”或“放熱”)反應。
(2)現有反應③CO2(g)+H2(g)?CO(g)+H2O(g),請你寫出該反應的平衡常數K3的數學表達式:K3=。
(3)能判斷反應③已達平衡狀態的是。
A.容器中壓強不變B.混合氣體中c(CO)不變
C.v正(H2)═v逆(H2O)D.c(CO2)═c(CO)
(4)根據反應①與②可推導出K1、K2與K3之間的關系式。據此關系式及上表數據,也能推斷出反應③是(填“吸熱”或“放熱”)反應。要使反應③在一定條件下建立的平衡向正反應方向移動,可采取的措施是(填寫序號)。
A.縮小反應容器容積
B.擴大反應容器容積
C.降低溫度
D.升高溫度
E.使用合適的催化劑
F.設法減少CO的量
(5)氫氣用于工業合成氨 N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1。
一定溫度下,在容積恒定的密閉容器中,一定量的N2和H2反應達到平衡后,改變某一外界條件,反應速率與時間的關系如圖所示,其中t4、t5、t7時刻所對應的實驗條件改變分別是t4;t5;t7。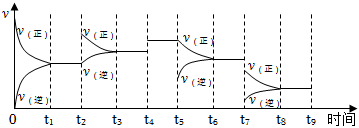 組卷:53引用:4難度:0.5
組卷:53引用:4難度:0.5


