2021-2022學年浙江省溫州市新力量聯盟高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:(本題共25小題,每題2分,共50分,每題只有一個正確選項)
-
1.下列反應的能量變化與其它三個不相同的是( )
A.鋁粉與氧化鐵的反應 B.氯化銨與消石灰的反應 C.鋅片與稀硫酸反應 D.鈉與冷水反應 組卷:66引用:28難度:0.9 -
2.下列物質的水溶液因水解而呈堿性的是( )
A.NaOH B.(NH4)2SO4 C.NaCl D.Na2CO3 組卷:19引用:2難度:0.8 -
3.下列說法中正確的是( )
A.ΔH<0的反應均是自發進行的反應 B.能夠自發進行的反應一定能迅速進行 C.冰在室溫下自動熔化成水,這是熵增的過程 D.能夠自發進行的反應一定是熵增的過程 組卷:14引用:2難度:0.7 -
4.反應A+B→C(△H<0)分兩步進行:①A+B→X(△H>0),②X→C(△H<0).下列示意圖中,能正確表示總反應過程中能量變化的是( )
A. 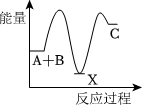
B. 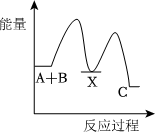
C. 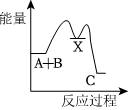
D. 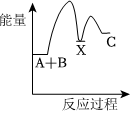 組卷:173引用:20難度:0.7
組卷:173引用:20難度:0.7 -
5.下列說法正確的是( )
A.參加反應的物質的性質是決定化學反應速率的主要因素 B.反應物的活化分子的每次碰撞都能發生化學反應 C.增大壓強,活化分子百分數增大,化學反應速率一定增大 D.一般使用催化劑可以降低反應的活化能,活化分子百分數不變,化學反應速率增大 組卷:7引用:2難度:0.7 -
6.下列措施一定能使反應速率加快的是( )
A.增加反應物的物質的量 B.升高溫度 C.縮小容器體積 D.加入生成物 組卷:50引用:14難度:0.7 -
7.常溫下,純水中存在電離平衡:H2O?H++OH-。欲使水的電離平衡向正方向移動,并使c(H+)增大,應加入的物質是( )
A.AlCl3 B.H2SO4 C.NaNO3 D.NaOH 組卷:27引用:2難度:0.8 -
8.一定條件下:2NO2(g)?N2O4(g)△H<0.在測定NO2的相對分子質量時,下列條件中,測定結果誤差最小的是( )
A.溫度0℃、壓強50kPa B.溫度130℃、壓強300kPa C.溫度25℃、壓強100kPa D.溫度130℃、壓強50kPa 組卷:524引用:34難度:0.6 -
9.下列過程或現象與鹽類水解無關的是( )
A.熱的純堿液用于去油污 B.配制FeCl3溶液時滴加少量鹽酸溶液 C.實驗室配制FeCl2溶液時,需要加入少量鐵粉 D.泡沫滅火器中的Al2(SO4)3溶液不能裝在鐵筒里 組卷:51引用:3難度:0.7 -
10.根據如圖所示的N2(g)和O2(g)反應生成NO(g)過程中的能量變化情況,判斷下列說法正確的是( )
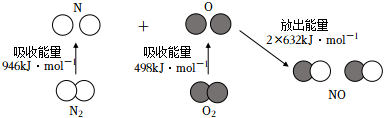
A.N2(g)和O2(g)反應生成NO(g)是放熱反應 B.2mol O原子結合生成O2(g)時需要吸收498kJ能量 C.1mol NO(g)分子中的化學鍵斷裂時需要吸收632kJ能量 D.N2(g)+O2(g)═2NO(g)的反應熱△H=+1444kJ?mol-1 組卷:43引用:7難度:0.7
二、非選擇題(本大題共7小題,共50分)
-
31.某燒堿樣品中含有少量不與酸作用的可溶性雜質,為了測定其純度,進行以下滴定操作:
A.在250mL容量瓶中配制250mL燒堿溶液
B.用移液管(或堿式滴定管)量取25.00mL燒堿溶液于錐形瓶中并加幾滴甲基橙指示劑
C.在天平上準確稱取燒堿樣品ω g,在燒杯中加蒸餾水溶解
D.將物質的量濃度為m mol?L-1的標準H2SO4溶液裝入酸式滴定管,調整液面,記下開始刻度V1mL
E.在錐形瓶下墊一張白紙,滴定到終點,記錄終點刻度為V2mL
請完成下列問題:
(1)正確的操作步驟是(填寫字母)→→→D→.
(2)滴定管讀數應注意.
(3)滴定到終點時錐形瓶內溶液的pH約為;終點時的顏色變化是.
(4)若酸式滴定管沒用標準H2SO4潤洗,會對測定結果有何影響(填“偏高”、“偏低”或“無影響”,其他操作均正確).
(5)該燒堿樣品的純度計算式是.組卷:14引用:2難度:0.5 -
32.二甲醚是一種重要的清潔燃料,也可替代氟利昂作制冷劑等,對臭氧層無破壞作用。工業上可利用煤的氣化產物(水煤氣)合成二甲醚。請回答下列問題:
(1)利用水煤氣合成二甲醚的三步反應如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
總反應:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=;
一定條件下的密閉容器中,該總反應達到平衡,要提高CO的轉化率,可以采取的措施是(填字母代號)。
a.高溫高壓 b.加入催化劑 c.減少CO2的濃度d。增加CO的濃度 e.分離出二甲醚
(2)已知反應②2CH3OH(g)?CH3OCH3(g)+H2O(g)某溫度下的平衡常數為400.此溫度下,在密閉容器中加入CH3OH,反應到某時刻測得各組分的濃度如下:
①此時正、逆反應速率的大小:v正物質 CH3OH CH3OCH3 H2O 濃度/(mol?L-1) 0.44 0.6 0.6 v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,經10min反應達到平衡,此時c(CH3OH)=;該時間內反應速率v(CH3OH)=。組卷:51引用:4難度:0.6


