2020-2021學年天津市楊村一中高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題<每小題有一個選項符合題意,每題3分,共54分)
-
1.下列說法正確的是( )
A.化學反應除了生成新的物質外,還伴隨著能量的變化 B.據能量守恒定律,反應物的總能量一定等于生成物的總能量 C.放熱的化學反應不需要加熱就能發生 D.吸熱反應不加熱就不會發生 組卷:379引用:30難度:0.9 -
2.下列措施肯定能使反應速率增大的是( )
A.增大反應物的量 B.適當升高溫度 C.增大壓強 D.減小生成物的量 組卷:25引用:1難度:0.5 -
3.在一定溫度下、一定體積條件下,能說明下列反應達到平衡狀態的是( )
A.反應2SO2(g)+O2(g)?2SO3(g) 容器內的密度不隨時間變化 B.反應A2(g)+B2(g)?2AB(g)容器內A2的消耗速率與AB消耗速率相等 C.反應N2+3H2?2NH3容器內氣體平均相對分子質量不隨時間變化 D.反應4A(s)+3B(g)?2C(g)+D(g)容器內氣體總壓強不隨時間變化 組卷:45引用:2難度:0.9 -
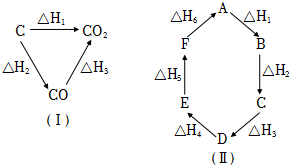 4.已知化學反應的熱效應只與反應物的初始狀態和生成物的最終狀態有關,例如圖(Ⅰ)所示:△H1=△H2+△H3根據上述原理和圖(Ⅱ)所示,判斷各對應的反應熱關系中不正確的是( )
4.已知化學反應的熱效應只與反應物的初始狀態和生成物的最終狀態有關,例如圖(Ⅰ)所示:△H1=△H2+△H3根據上述原理和圖(Ⅱ)所示,判斷各對應的反應熱關系中不正確的是( )A.A→F△H=-△H6 B.A→D△H=△H1+△H2+△H3 C.△H1+△H2+△H3+△H4+△H5+△H6=0 D.△H1+△H6=△H2+△H3+△H4+△H5 組卷:92引用:5難度:0.7 -
5.在1L密閉容器中進行如下反應:X(g)+3Y(g)?2Z(g),達到平衡時X、Y、Z的物質的量分別為0.1mol、0.3mol、0.2mol,保持溫度和容器體積不變時,再向容器中充入X、Y、Z的物質的量0.1mol、0.3mol、0.2mol,則下列說法正確的是( )
A.化學平衡常數不變,平衡不移動 B.向正反應方向移動 C.向逆反應方向移動 D.容器內壓強始終保持原來的2倍 組卷:137引用:5難度:0.5 -
6.下列說法或表示方法中正確的是( )
A.相同條件下,等質量的硫蒸氣和硫固體分別完全燃燒,前者的熱效應△H>后者的△H B.由C(石墨)→C(金剛石)△H=+1.9kJ/mol,可知金剛石比石墨穩定 C.已知在101KPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,則有關氫氣燃燒熱的熱化學方程式為:2H2(g)+O2(g)=2H2O(l)△H=+285.8kJ/mol D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,若將含0.5 mol硫酸的濃硫酸與含1 molNaOH的溶液混合,放出的熱量大于57.3 kJ 組卷:35引用:1難度:0.5 -
7.下列說法正確的是( )
A.增大反應物濃度可以增大活化分子百分數,從而使反應速率增大 B.汽車尾氣的催化轉化裝置可將尾氣中的NO和CO等有害氣體快速地轉化為N2和CO2,其原因是催化劑可增大NO和CO反應的活化能 C.鋅與稀硫酸制備氫氣,加入少量的硫酸銅溶液,生成H2的速率加快 D.在“中和熱的測量實驗”中測定反應后溫度的操作方法:將量筒中的NaOH溶液經玻璃棒引流緩緩倒入盛有鹽酸的簡易量熱計中,立即蓋上蓋板,并用環形玻璃攪拌棒不斷攪拌,準確讀出并記錄反應體系的最高溫度 組卷:38引用:1難度:0.5 -
8.一定條件下,某容積不變的密閉容器內存在下列平衡:2HI(g)?H2(g)+I2(g);則下列有關說法正確的是( )
A.如改變體系溫度,體系顏色一定發生變化 B.如僅僅改變濃度這一條件,使得體系顏色加深,則上述平衡一定正移 C.繼續充入HI氣體,則HI的轉化率將減小 D.溫度不變時,當體系顏色變淺,則正反應速率和逆反應速率都將減小 組卷:47引用:4難度:0.7
二、填空題(共46分)。
-
23.已知2A2(g)+B2(g)?2C3(g);ΔH=-Q1 kJ/mol(Q1>0),在一個有催化劑的容積不變的密閉容器中加入2molA2和1molB2,在500℃時充分反應,達平衡后C3的濃度為w mol?L-1,放出熱量為Q2 kJ.
(1)達到平衡時,A2的轉化率為.
(2)達到平衡后,若向原容器中通入少量的氬氣,A2的轉化率將(填“增大”、“減小”或“不變”)
(3)若在原來的容器中,只加入2mol C3,500℃時充分反應達平衡后,吸收熱量Q3 kJ,C3濃度(填>、=、<)w mol?L-1,Q1、Q2、Q3 之間滿足何種關系:Q3=
(4)改變某一條件,得到如圖的變化規律(圖中T表示溫度,n表示物質的量),可得出的結論正確的是;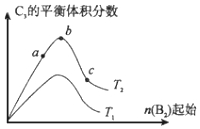
a.反應速率c>b>a
b.達到平衡時A2的轉化率大小為:b>a>c
c.T2>T1
d.b點A2和B2的物質的量之比為2:1
(5)若將上述容器改為恒壓容容器,起始時加入4molA2和2molB2,500℃時充分反應達平衡后,放出熱量Q4kJ,則Q2Q4 (填“>”、“<”或“=”).
(6)下列措施可以同時提高反應速率和B2的轉化率是(填選項序號).
a.選擇適當的催化劑 b.增大壓強 c.及時分離生成的C3 d.升高溫度.組卷:71引用:5難度:0.3 -
24.高爐煉鐵過程中發生的主要反應為
Fe2O3+CO(g)?13Fe(s)+CO2(g),已知該反應在不同溫度下的平衡常數如下:23
請回答下列問題:溫度/℃ 1000 1150 1300 平衡常數 4.0 3.7 3.5
(1)△H(填“>”“<”或“=”)0。
(2)在一個容積為10L的密閉容器中,1000℃時加入Fe、Fe2O3、CO、CO2各1.0mol,反應經過10min后達到平衡。則該時間范圍內反應的平均反應速率υ(CO2)=,CO的轉化率=。組卷:39引用:1難度:0.5


