2023年湖南省郴州一中高考化學模擬試卷(六)
發布:2024/4/20 14:35:0
一、選擇題(本題共14小題,每小題3分,共42分,每小題只有一個選項符合題意。)
-
1.化學與能源、材料和環境密切相關。下列有關說法錯誤的是( )
A.我國科學家研制的層狀磷酸鋯材料可除去廢水中的 Sr,9038Sr中含有的中子數為529038B.我國科學家利用赤泥和玉米秸稈制備的新型多孔生物炭具有強吸附性 C.杭州2022年第19屆亞運會“薪火“火炬使用了1070鋁合金,鋁合金屬于金屬材料 D.我國科學家制備了一種新型的催化劑InNi3Co0.5/Fe3O4,該催化劑中只含主族元素 組卷:46引用:5難度:0.6 -
2.NA為阿伏加德羅常數的值。下列敘述正確的是( )
A.6gNa37Cl中含有的電子數為2.8NA B.標準狀況下,11.2LCHCl3含有的分子數為0.5NA C.物質的量相等的苯、苯乙烯混合物中含C-H鍵數為7NA D.25℃,0.1LpH=1的鹽酸稀釋十倍,含有的OH-數為1×10-14NA 組卷:12引用:2難度:0.6 -
3.下列物質性質實驗對應的離子方程式書寫正確的是( )
A.Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ B.Fe(OH)3溶于氫碘酸:Fe(OH)3+3H+═Fe3++3H2O C.同濃度同體積NH4HSO4溶液與NaOH溶液混合:NH4++OH-═NH3?H2O D.Na2S2O3 溶液中通入足量氯氣:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+ 組卷:162引用:3難度:0.5 -
4.中國自古有“信口雌黃”“雄黃入藥”之說。雌黃As2S3和雄黃As4S4都是自然界中常見的砷化物,早期都曾用作繪畫顏料,因都有抗病毒療效也用來入藥。砷元素有+2、+3兩種常見價態。一定條件下,雌黃和雄黃的轉化關系如圖所示。下列說法錯誤的是( )

A.反應Ⅰ中,As2S3和SnCl2的物質的量之比為1:1時可恰好完全反應 B.反應Ⅱ中,物質a可能是S、SO2 C.反應Ⅰ、Ⅱ、Ⅳ是氧化還原反應;反應Ⅲ是非氧化還原反應 D.反應Ⅰ可用NaOH溶液吸收H2S,向吸收后的溶液中加入足量稀硫酸可為反應Ⅳ提供H2S 組卷:43引用:4難度:0.7 -
 5.l966年,W.E.Barth和R.G.Lawton首次合成了一類碗狀化合物,將其命名為Corannulen中文名稱為碗烯或心環烯,其結構如圖所示。下列有關該有機物的說法錯誤的是( )
5.l966年,W.E.Barth和R.G.Lawton首次合成了一類碗狀化合物,將其命名為Corannulen中文名稱為碗烯或心環烯,其結構如圖所示。下列有關該有機物的說法錯誤的是( )A.屬于芳香烴 B.不溶于水,與苯互為同系物 C.可以發生取代反應和加成反應 D.完全燃燒生成CO2和H2O的物質的量之比為4:1 組卷:27引用:2難度:0.6 -
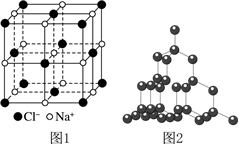 6.金剛石硬度大,熔點高,用途非常廣泛。工業上利用反應CCl4+4NaC(金剛石)+4NaCl人工合成金剛石。已知:氯化鈉晶胞結構如圖1所示,相鄰的Na+與Cl-的距離為acm。設NA為阿伏加德羅常數的值,下列有關說法錯誤的是( )973KNi-Co
6.金剛石硬度大,熔點高,用途非常廣泛。工業上利用反應CCl4+4NaC(金剛石)+4NaCl人工合成金剛石。已知:氯化鈉晶胞結構如圖1所示,相鄰的Na+與Cl-的距離為acm。設NA為阿伏加德羅常數的值,下列有關說法錯誤的是( )973KNi-CoA.Ni、Co均屬于元素周期表中的ds區元素 B.CCl4、NaCl、金剛石晶體類型不同 C.若NaCl晶體密度為dg?cm-3,則NA= 58.52a3dD.12g金剛石(晶體結構如圖2所示)中含有C-C鍵的數目為2NA 組卷:35引用:2難度:0.6
二、非選擇題(本題共4小題,共58分。)
-
17.研究含氮元素物質的反應對生產、生活、科研等方面具有重要的意義。
(1)發射“神舟十三”號的火箭推進劑為液態四氧化二氮和液態偏二甲肼(C2H8N2)。
已知:①C2H8N2(l)+4O2(g)═2CO(g)+N2(g)+4H2O(l)ΔH=-2765.0kJ?mol-1
②2O2(g)+N2(g)═N2O4(l)ΔH2=-19.5kJ?mol-1
③H2O(g)═H2O(l)ΔH3=-44.0kJ?mol-1
則C2H8N2(l)+2N2O4(1)═3N2(g)+2CO2(g)+4H2O(g)的ΔH為。
(2)碘蒸氣存在能大幅度提高N2O的分解速率,反應歷程為:
第一步:I2(g)→2I(g)(快反應)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反應)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反應)
實驗表明,含碘時N2O分解速率方程v=k?c(N2O)?[c(I2)]0.5(k為速率常數)。下列表述正確的是。
A.N2O分解反應中,k值與碘蒸氣濃度大小有關
B.v(第二步的逆反應)<v(第三步反應)
C.IO為反應的催化劑
D.第二步活化能比第三步大
(3)為避免汽車尾氣中的氮氧化合物對大氣的污染,需給汽車安裝尾氣凈化裝置。在凈化裝置中CO和NO發生反應2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=-746.8kJ?mol-1。
實驗測得:v正=k正?p2(NO)?p2(CO),v正=k逆p(N2)?p2(CO2)。其中k正、k逆分別為正、逆反應速率常數,只與溫度有關;p為氣體分壓(分壓=物質的量分數×總壓)。
①達到平衡后,僅升高溫度,k增大的倍數(填“大于”“小于”或“等于”)k增大的倍數。
②一定溫度下在剛性密閉容器中充入CO、NO和N2物質的量之比為2:2:1,壓強為pokPa。達平衡時壓強為0.9pokPa,則=k正k逆。
(4)我國科技人員計算了在一定溫度范圍內下列反應的平衡常數Kp:
①3N2H4(1)=4NH3(g)+N2(g)ΔH1 Kp1
②4NH3(g)=2N2(g)+6H2(g)ΔH2 Kp2
繪制pKp1-T和pKp2-T的線性關系圖如圖所示:(已知:pKp=-1gKp)
①由圖可知,ΔH10(填“>”或“<”)。
②反應3N2H4(1)=3N2(g)+6H2(g)的K=(用Kp1、Kp2表示);該反應的ΔH0 (填“>”或“<”),寫出推理過程。組卷:67引用:6難度:0.6 -
18.光刻膠的生產流程如圖(部分試劑和產物略去)。

已知.① +
+ 稀NaOH溶液△
稀NaOH溶液△ (R1、R2為羥基或氫原子);
(R1、R2為羥基或氫原子);
② +R4OH 一定條件
+R4OH 一定條件 +HCl (R3、R4為烴基)。
+HCl (R3、R4為烴基)。
(1)羧酸X的名稱為,E的核磁共振氫譜為三組峰,且峰面積之比為3:2:1,E能發生水解反應,則E中所含官能團名稱為。
(2)D的分子式為。
(3)若試劑Y為銀氨溶液,寫出反應①的化學方程式:,由C到D的反應類型為。
(4)光刻膠的結構簡式為。
(5)C的同分異構體滿足下列條件:①能發生銀鏡反應,其水解產物之一能與FeCl3溶液發生顯色反應;②除苯環外不含其他環狀結構;則該同分異構體共有種。
(6)根據已有知識并結合相關信息,寫出以CH3CHO為原料制備CH3CH2CH2COOH的合成路線流程圖(無機試劑任選)。組卷:22引用:2難度:0.5


