2020-2021學年黑龍江省哈爾濱六中高一(下)月考化學試卷(4月份)
發布:2024/4/20 14:35:0
一、單選題(每小題2分,共50分)
-
1.中國傳統文化對人類文明貢獻巨大,也蘊含著很多化學知識,下列說法不正確的是( )
A.《清波雜志》卷十二:“信州鉛山膽水自山下注,勢若瀑布……古傳一人至水濱,遺匙鑰,翌日得之,已成銅矣。”這里的膽水是指CuSO4溶液 B.《黃鶴樓送孟浩然之廣陵》中“故人西辭黃鶴樓,煙花三月下揚州”,“煙花”是焰色反應 C.“綠蟻新醅酒,紅泥小火爐”中的“紅泥”是因其含有氧化鐵 D.《傅鶉觚集?太子少傅箴》中記載:“故近朱者赤,近墨者黑。”這里的“朱”指的是朱砂,古代常用的一種紅色顏料,其主要成分是HgS 組卷:58引用:3難度:0.7 -
2.為了降低硫氧化物造成的空氣污染,一種方法是在含硫燃料(如煤)燃燒過程中加入生石灰,這種方法叫“鈣基固硫”,采用這種方法在燃料燃燒過程中不涉及“固硫”的反應是(反應條件略)( )
A.CaO+H2O=Ca(OH)2 B.S+O2=SO2 C.CaO+SO2=CaSO3 D.2CaSO3+O2=2CaSO4 組卷:149引用:1難度:0.3 -
3.對下列事實的解釋錯誤的是( )
A.在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有脫水性 B.濃硝酸在光照下顏色變黃,說明濃硝酸不穩定 C.常溫下,濃硝酸可以用鋁制器皿貯存,說明鋁與濃硝酸不反應 D.將SO2通入BaCl2溶液至飽和,未見沉淀生成,繼續通入另一種氣體,有白色沉淀,則通入的氣體可能是NH3 組卷:36引用:4難度:0.7 -
4.下列說法正確的是( )
A.反應H2S+H2SO4(濃)═SO2↑+S↓+2H2O中SO2是氧化產物 B.向FeCl3和CuSO4的混合溶液中加入少量鐵粉發生的反應為2Fe3++Fe═3Fe2+ C.濃硫酸有強氧化性,但沒有酸性 D.濃、稀硝酸的還原產物分別是NO2和NO,且前者常溫下遇鐵片沒有明顯變化,因此濃硝酸氧化性弱于稀硝酸 組卷:47引用:2難度:0.7 -
5.下列說法正確的是( )
A.N2O5屬于酸性氧化物 B.氨氣、二氧化硫和鐵都屬于非電解質 C.CO2、SO2、NO2均為空氣污染物 D.氧化鈣常用在食品袋中做“去氧劑” 組卷:24引用:1難度:0.6 -
6.下列說法中正確的是( )
A.硫與金屬或非金屬反應均作氧化劑 B.試管內壁上的硫黃可用二硫化碳清洗 C.過量的硫與鐵反應生成Fe2S3,表現了硫單質的氧化性 D.硫只以化合態形式存在于自然界中 組卷:34引用:3難度:0.7 -
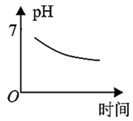 7.某同學用二氧化硫溶于水模擬形成酸雨水樣,進行分析,發現其pH隨時間變化的關系如圖,則其pH變化的主要原因是( )
7.某同學用二氧化硫溶于水模擬形成酸雨水樣,進行分析,發現其pH隨時間變化的關系如圖,則其pH變化的主要原因是( )A.亞硫酸的電離程度不斷增大 B.亞硫酸在空氣中被緩慢氧化成硫酸 C.酸雨水樣中的水分被太陽照射蒸發 D.酸雨水樣中的二氧化硫轉化為亞硫酸鹽 組卷:6引用:1難度:0.6 -
8.只用一種試劑就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四種溶液區分開來,這種試劑是( )
A.AgNO3 B.Ba(OH)2 C.NaOH D.BaCl2 組卷:17引用:3難度:0.6 -
9.海鹽經溶解、過濾后仍含有可溶性雜質Ca2+、Mg2+、SO42-,為了得到純凈的NaCl,下列試劑(均過量)的滴加順序及操作順序不合理的是( )
A.BaCl2溶液→NaOH溶液→Na2CO3溶液→過濾→稀鹽酸→蒸發結晶 B.Ba(OH)2溶液→Na2CO3溶液→過濾→稀鹽酸→蒸發結晶 C.Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾→稀鹽酸→蒸發結晶 D.BaCl2溶液→Na2CO3溶液→NaOH溶液→過濾→稀鹽酸→蒸發結晶 組卷:32引用:5難度:0.6
二、填空題(共50分)
-
28.如圖是部分常見元素的單質及其化合物的轉化關系圖(有關反應的條件及生成的部分產物已略去)。已知:E為紅棕色固體,K為淺綠色溶液;反應①②是化工生產中的重要反應;B、C、D、H是單質;B、C、D、F、G、H常溫下是氣態;F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物質之一;N是一種常見的氮肥;化合物G為極易溶于水且易液化。
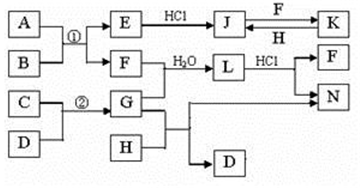
(1)化合物A中含有的短周期元素是(寫元素符號),E的化學式。
(2)如何檢驗化合物N中的陽離子。
(3)寫出J與F反應的離子方程式:,G與H反應的化學方程式:。
(4)等物質的量F和H的混合氣體通入品紅溶液中的現象為,原因是(用化學反應方程式表示)。
(5)實驗室制取G的化學方程式:。組卷:9引用:1難度:0.4 -
29.今年我國多個城市遭遇霧霾天氣,這表明污染嚴重,空氣質量下降。因此研究NO2、SO2、CO等大氣污染氣體的處理具有重要現實意義。
(1)NO2可用水吸收,相應的化學反應方程式為。
(2)利用反應6NO2+8NH37N2+12H2O也可處理NO2。當轉移2.4mol電子時,消耗的NO2在標準狀況下的體積是催化劑L。
(3)3.2gCu與30mL 8mol?L-1HNO3反應,硝酸的還原產物為NO,NO2,反應后溶液中所含H+為0.1mol,則:
①溶液中n(NO3-)為mol。
②所生成的NO在標準狀況下體積為L。
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物質的量濃度分別是3mol?L-1和1mol?L-1,取100mL此混合酸,向其中加入過量的鐵粉,待反應結束后,可產生標準狀況下的氣體的體積為L(設反應中HNO3被還原成NO)。組卷:15引用:1難度:0.6


