2020-2021學年山西省忻州一中高二(上)開學化學試卷
發布:2025/1/3 7:0:2
一、選擇題(本大題共14小題,每小題3分,共42分.每小題只有一個選項是符合題目要求的)
-
1.化學與生產、生活、社會密切相關。下列有關說法正確的是( )
A.煤經過氣化和液化等物理變化可轉化為清潔燃料 B.為了提高酒精的殺菌消毒效果,醫院常用體積分數為100%的酒精 C.用浸泡過酸性高錳酸鉀溶液的硅藻土吸收水果釋放的乙烯,可達到水果保鮮的目的 D.合成不粘鍋涂層的原料CF2=CF2為烴類化合物 組卷:6引用:1難度:0.6 -
2.下列化學用語正確的是( )
A.結構簡式(CH3)2CHCH3既可以表示正丁烷,也可以表示異丁烷 B.丙烷分子的比例模型: 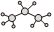
C.甲烷分子的球棍模型: 
D.乙烷分子的電子式: 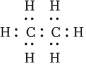 組卷:101引用:9難度:0.8
組卷:101引用:9難度:0.8 -
3.硫酸亞鐵銨受熱分解的反應方程式為2(NH4)2Fe(SO4)2
Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,用NA表示阿伏加德羅常數的值。下列說法正確的是( )高溫A.標準狀況下。每生成15.68L氣體轉移電子數目為0.8NA B.將1mol SO2和1mol O2充分反應后,其分子總數為1.5NA C.1L 0.1 mol?L-1(NH4)2Fe(SO4)2溶液中Fe2+的數目為0.1NA D.常溫常壓下,3.0g 15N2中含有的中子總數為1.4NA 組卷:22引用:1難度:0.6 -
4.下列反應的離子方程式正確的是( )
A.向明礬溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ B.將SO2氣體通入NaClO溶液中:SO2+2ClO-+H2O═SO42-+2HClO C.在強堿溶液中次氯酸鈉與Fe(OH)3反應生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ D.VO2+與酸性高錳酸鉀溶液反應:5VO2++MnO4-+H2O═Mn2++5VO2++2H+ 組卷:69引用:2難度:0.5 -
5.短周期主族元素X、Y、Z、Q的原子序數依次增大,它們在元素周期表中的相對位置如表所示。X的最外層電子數是內層電子數的兩倍,Y、Z屬于同主族,下列說法正確的是( )
X Y Z Q A.簡單氣態氫化物的穩定性:X>Q B.原子半徑:X<Y<Z C.形成化合物的種類:X>Q D.最高價氧化物對應水化物的酸性:Z>Q 組卷:14引用:1難度:0.5 -
6.下列說法正確的是( )
A.用溴水可以鑒別己烯、己烷、四氯化碳三種有機物 B.利用油脂在堿性條件下水解,可以得到甘油和高級脂肪酸 C.油脂、纖維素、淀粉和蛋白質都是高分子化合物 D.1mol苯恰好與3mol氫氣完全加成,說明一個苯分子中有三個碳碳雙鍵 組卷:16引用:1難度:0.8
二、非選擇題(本大題共6小題,共58分)
-
19.CO2 是一種主要的溫室氣體。研究CO2 的利用對促進低碳社會的實現具有重要的意義
(1)金剛石和石墨的燃燒反應中的能量變化如圖所示。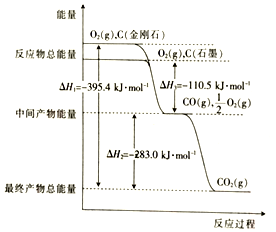
①金剛石的燃燒熱(△H)為kJ/mol;石墨不完全燃燒生成CO的熱化學方程式為。
②下列說法中正確的是。
A.石墨和金剛石互為同素異形體
B.石墨轉化為金剛石要放出能量
C.等質量的石墨與金剛石完全燃燒,石墨放出的能量多
D.通常狀況下,石墨比金剛石穩定
③石墨轉化為金剛石的熱化學方程式為。
(2)以CO2為原料還可合成多種物質,工業上常以CO2(g)與H2(g)為原料合成乙醇。已知:CO(g)+H2O(l)?CO2(g)+H2(g)△H=+2.8kJ?mol-1
2CO(g)+H2(g)?CH3CH2OH(g)+H2O(l)△H=-300.1kJ?mol-1
則2CO2(g)+H2(g)?CH3CH2OH(g)+3H2O(l)△H=。組卷:8引用:2難度:0.6 -
20.在1.0L真空密閉容器中充入4.0mol A(g)和4.0mol B(g),在一定溫度下進行反應:A(g)+B(g)?C(g)ΔH,測得不同時刻該容器內物質的物質的量如下表:
回答下列問題:時間/min 0 10 20 30 40 n(A)/mol 4.0 2.5 1.5 n2 n3 n(C)/mol 0 1.5 n1 3 3
(1)隨著溫度的升高,該反應的化學平衡常數減小,則ΔH(填“>”“<”或“=”)0,反應從起始到20min內C的平均反應速率是。
(2)該溫度下,上述反應的化學平衡常數為。平衡時體系內氣體的總壓強是反應起始時總壓強的。
(3)下列選項中能說明該反應在一定溫度和恒容條件下達到平衡狀態的是。
A.反應速率:vA(正)+vB(正)=vC(逆)
B.A的質量不再改變
C.B的轉化率不再改變
D.密度不再改變
(4)若反應C(g)?A(g)+B(g)進行時需加入稀釋劑X氣體(不參與反應),則C的平衡轉化率與體系的溫度、壓強、X的物質的量的關系如圖1、圖2所示。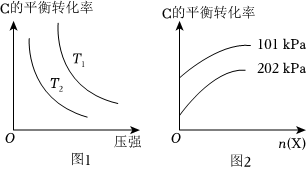
①由圖1可知,T1(填“>”“<”或“=”)T2。
②由圖2可知,當其他條件不變時,增大X的物質的量,C的平衡轉化率將(填“增大”“減小”或“不變”),其原因是。組卷:23引用:4難度:0.5


