魯教新版九年級下冊《8.3 海水“制堿”》2017年同步練習卷
發布:2024/12/5 22:0:2
一、選擇題(共4小題,每小題3分,滿分12分)
-
1.小蘇打是發酵粉的主要成分之一,其化學式為( )
A.NaCl B.NaOH C.Na2CO3 D.NaHCO3 組卷:166引用:4難度:0.9 -
2.檢驗碳酸鹽化合物最好的試劑是( )
A.稀鹽酸、澄清石灰水 B.稀鹽酸 C.澄清石灰水 D.稀鹽酸、帶火星的木條 組卷:31引用:4難度:0.9 -
3.氨堿法生產純堿的主要反應原理如下:
(1)NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl
(2)2NaHCO3Na2CO3+CO2↑+H2O。加熱
對上述信息的有關理解不正確的是( )A.用食鹽制純堿需要含碳、氧元素的物質 B.(1)中析出晶體后剩余溶液只有一種溶質 C.氨鹽水比食鹽水更易吸收二氧化碳 D.碳酸氫鈉比碳酸鈉受熱更易分解 組卷:285引用:25難度:0.9 -
4.我國制堿工業的先驅-侯德榜先生,1921年留美回國后,潛心研究制堿技術,發明了將制堿與制氨結合起來的聯合制堿法(又稱侯氏制堿法),為純堿和氮肥工業技術的發展作出了杰出貢獻.下列物質中能與純堿發生反應的是( )
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4 組卷:442引用:18難度:0.7
二、解答題(共1小題,滿分0分)
-
5.氨堿法制純堿的工業流程如下:

(1)最終所得純堿主要成分的化學式是,它屬于(填“酸”“堿”或“鹽”),該產品易溶于水,溶液顯性。
(2)由步驟③所得的碳酸氫鈉在生產和生活中有許多重要用途,在醫療上,它是治療過多的藥劑之一。
(3)試寫出步驟 ④中發生反應的化學方程式。組卷:23引用:5難度:0.3
三、選擇題(共2小題,每小題3分,滿分6分)
-
6.“NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl”是著名的“侯氏制堿法”的重要反應,下列有關敘述正確的是( )
A.NaHCO3是純堿 B.析出晶體后剩余溶液中溶質只有NH4Cl C.配制飽和食鹽水時,可通過攪拌來提高食鹽的溶解度 D.向飽和食鹽水中先通入氨氣的作用是使溶液呈堿性,促進二氧化碳的吸收 組卷:436引用:18難度:0.7 -
7.實驗室中有兩瓶失去標簽的稀鹽酸和氯化鈉溶液,下列四種試劑中能將其鑒別出來的是( )
A.AgNO3溶液 B.無色酚酞試液 C.K2CO3溶液 D.Na2SO4溶液 組卷:507引用:14難度:0.7
八、解答題(共2小題,滿分0分)
-
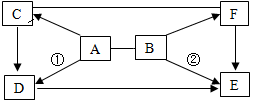 20.A~F是初中化學常見的六種物質,它們之間的關系如圖所示(“→”表示物質間的轉化關系,“-”表示兩種物質能相互反應;部分反應物、生成物及反應條件未標出)。物質A可以與酸、堿、鹽三類物質發生反應,D是廚房中常用的調味品,F的溶液呈黃色,反應①和②都有白色沉淀生成,請回答:
20.A~F是初中化學常見的六種物質,它們之間的關系如圖所示(“→”表示物質間的轉化關系,“-”表示兩種物質能相互反應;部分反應物、生成物及反應條件未標出)。物質A可以與酸、堿、鹽三類物質發生反應,D是廚房中常用的調味品,F的溶液呈黃色,反應①和②都有白色沉淀生成,請回答:
(1)寫出A、C、D的化學式:A、C、D。
(2)寫出①的基本反應類型是。
(3)反應②的化學方程式為。組卷:523引用:10難度:0.5 -
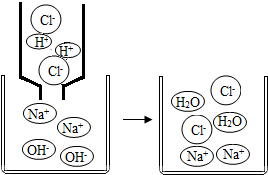 21.初中化學中,我們學習了酸和堿發生中和反應的實質是H++OH-═H2O.如圖,像這種用實際參加反應的離子符號來表示反應的式子叫離子方程式。離子方程式的書寫一般按以下步驟:(以Na2SO4與BaCl2反應為例)
21.初中化學中,我們學習了酸和堿發生中和反應的實質是H++OH-═H2O.如圖,像這種用實際參加反應的離子符號來表示反應的式子叫離子方程式。離子方程式的書寫一般按以下步驟:(以Na2SO4與BaCl2反應為例)
①寫出Na2SO4與BaCl2反應的化學方程式:;
②把易溶于水、易電解的物質寫成離子形式,把難溶的物質、氣體和水等仍用化學式表示。上述方程式可改寫成:2Na++SO42-+Ba2++2Cl-═BaSO4↓+2Na++2Cl-
③刪去方程式兩邊不參加反應的離子:Ba2++SO42-═BaSO4↓
④檢查方程式兩邊各元素的原子個數和電荷總數是否相等。
請回答:
(1)下列各組中的離子,在pH=3的水溶液中能大量共存的是
A、Na+、Mg2+、Cl-、SO4 2- B、Na+、K+、Cl-、OH-
C、Na+、Cu2+、Cl-、SO42- D、Na+、K+、Cl-、CO32-
(2)寫出稀鹽酸滴在石灰石上所發生反應的離子方程式;
(3)寫出一個與離子方程式Mg+2H+═Mg2++H2↑相對應的化學方程式;
(4)酸、堿、鹽在水溶液中發生的復分解反應實質上就是兩種化合物在溶液中相互交換離子的反應,只要具備生成物中有氣體或沉淀或生成,反應就能發生。組卷:346引用:10難度:0.3


