2022年湖北省新高考化學試卷(選擇性)
發布:2025/1/7 23:0:2
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學與生活密切相關,下列不涉及化學變化的是( )
A.加入明礬后泥水變澄清 B.北京冬奧會用水快速制冰 C.燉排骨湯時加點醋味道更鮮 D.切開的茄子放置后切面變色 組卷:248引用:6難度:0.8 -
 2.蓮藕含多酚類物質,其典型結構簡式如圖所示。下列有關該類物質的說法錯誤的是( )
2.蓮藕含多酚類物質,其典型結構簡式如圖所示。下列有關該類物質的說法錯誤的是( )A.不能與溴水反應 B.可用作抗氧化劑 C.有特征紅外吸收峰 D.能與Fe3+發生顯色反應 組卷:377引用:2難度:0.6 -
3.武當山金殿是銅鑄鎏金大殿。傳統鎏金工藝是將金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附著在器物表面。下列說法錯誤的是( )
A.鎏金工藝利用了汞的揮發性 B.鎏金工藝中金發生了化學反應 C.鎏金工藝的原理可用于金的富集 D.用電化學方法也可實現銅上覆金 組卷:309引用:5難度:0.5 -
4.下列各組離子在給定溶液中能大量共存的是( )
A.在0.1mol?L-1氨水中:Ag+、Cu2+、NO 、SO-32-3B.在0.1mol?L-1氯化鈉溶液中:Fe3+、I-、Ba2+、HCO -3C.在0.1mol?L-1醋酸溶液中:SO 、NH2-4、Br-、H++4D.在0.1mol?L-1硝酸銀溶液中:K+、Cl-、Na+、CO 2-3組卷:940引用:8難度:0.7 -
5.化學物質與生命過程密切相關,下列說法錯誤的是( )
A.維生素C可以還原活性氧自由基 B.蛋白質只能由蛋白酶催化水解 C.淀粉可用CO2為原料人工合成 D.核酸可視為核苷酸的聚合產物 組卷:187引用:3難度:0.8 -
6.下列實驗裝置(部分夾持裝置略)或現象錯誤的是( )
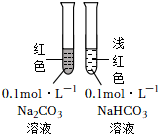
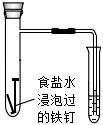
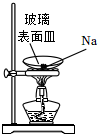
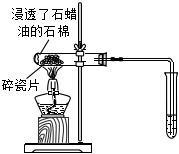
A.滴入酚酞溶液 B.吸氧腐蝕 C.鈉的燃燒 D.石蠟油的熱分解 A.A B.B C.C D.D 組卷:458引用:5難度:0.7
二、非選擇題:本題共4小題,共55分。
-
18.全球對鋰資源的需求不斷增長,“鹽湖提鋰”越來越受到重視。某興趣小組取鹽湖水進行濃縮和初步除雜后,得到濃縮鹵水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+),并設計了以下流程通過制備碳酸鋰來提取鋰。

25℃時相關物質的參數如下:LiOH的溶解度:12.4g/100gH2O化合物 Ksp Mg(OH)2 5.6×10-12 Ca(OH)2 5.5×10-6 CaCO3 2.8×10-9 Li2CO3 2.5×10-2 
回答下列問題:
(1)“沉淀1”為。
(2)向“濾液1”中加入適量固體Li2CO3的目的是。
(3)為提高Li2CO3的析出量和純度,“操作A”依次為、、洗滌。
(4)有同學建議用“侯氏制堿法”的原理制備Li2CO3。查閱資料后,發現文獻對常溫下的Li2CO3有不同的描述:①是白色固體;②尚未從溶液中分離出來。為探究LiHCO3的性質,將飽和LiCl溶液與飽和NaHCO3溶液等體積混合,起初無明顯變化,隨后溶液變渾濁并伴有氣泡冒出,最終生成白色沉淀。上述現象說明,在該實驗條件下LiHCO3(填“穩定”或“不穩定”),有關反應的離子方程式為。
(5)他們結合(4)的探究結果,擬將原流程中向“濾液2”加入Na2CO3改為通入CO2。這一改動能否達到相同的效果,作出你的判斷并給出理由。組卷:551引用:5難度:0.3 -
19.自發熱材料在生活中的應用日益廣泛。某實驗小組為探究“CaO-Al-H2O”體系的發熱原理,在隔熱裝置中進行了下表中的五組實驗,測得相應實驗體系的溫度升高值(ΔT)隨時間(t)的變化曲線,如圖所示。
回答下列問題:實驗編號 反應物組成 
a 0.20gCaO粉末5.0mLH2O b 0.15gAl粉5.0mLH2O c 0.15gAl粉5.0mL飽和石灰水 d 0.15gAl粉5.0mL石灰乳 e 0.15gAl粉、0.20gCaO粉末5.0mLH2O
(1)已知:
①CaO(s)+H2O(l)═Ca(OH)2(s)ΔH1=-65.17kJ?mol-1
②Ca(OH)2(s)═Ca2+(aq)+2OH-(aq)ΔH2=-16.73kJ?mol-1
③Al(s)+OH-(aq)+3H2O(l)═[Al(OH)4]-(aq)+H2(g)ΔH3=-415.0kJ?mol-132
則CaO(s)+2Al(s)+7H2O(l)═Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g)的ΔH4=kJ?mol-1。
(2)溫度為T時,Ksp[Ca(OH)2]=x,則Ca(OH)2飽和溶液中c(OH-)=(用含x的代數式表示)。
(3)實驗a中,4min后ΔT基本不變,原因是。
(4)實驗b中,ΔT的變化說明Al粉與H2O在該條件下(填“反應”或“不反應”)。實驗c中,前3min的ΔT有變化,其原因是;3min后ΔT基本不變,其原因是微粒的量有限。
(5)下列說法不能解釋實驗d在10min內溫度持續升高的是(填標號)。
A.反應②的發生促使反應①平衡右移
B.反應③的發生促使反應②平衡右移
C.氣體的逸出促使反應③向右進行
D.溫度升高導致反應速率加快
(6)歸納以上實驗結果,根據實驗e的特征,用文字簡述其發熱原理。組卷:337引用:2難度:0.5


