2020-2021學年陜西省寶雞市鳳翔中學高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一.選擇題(共10小題,每小題4分,共40分)
-
1.形成節(jié)約能源和保護生態(tài)環(huán)境的產業(yè)結構是人類與自然和諧發(fā)展的重要保證,你認為下列行為中有悖于這一保證的是( )
A.開發(fā)太陽能、水能、風能等新能源,減少使用煤、石油等化石燃料 B.研究采煤、采油新技術,提高產量以滿足工業(yè)生產的快速發(fā)展 C.在農村推廣使用沼氣 D.減少資源消耗、增加資源的重復使用和資源的循環(huán)再生 組卷:59引用:9難度:0.9 -
2.下列各組關于強電解質、弱電解質、非電解質的歸類,完全正確的是( )
選項 A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H3PO4 Fe(OH)3 非電解質 蔗糖 BaSO4 酒精 H2O A.A B.B C.C D.D 組卷:56引用:6難度:0.7 -
3.下列對選修四教材中的數據敘述正確的是( )
A.單獨利用焓變的數據或熵變的數據就能判斷化學反應能否自發(fā)進行 B.利用一元弱酸的電離平衡常數相對大小可以判斷其相應可溶性鹽的水解程度的相對大小 C.利用反應熱數據的大小可以判斷不同反應的反應速率的大小 D.利用溶液的pH與7的大小關系,可以判斷任何溫度下溶液的酸堿性 組卷:4引用:2難度:0.7 -
4.熱化學離不開實驗,更離不開對反應熱的研究。下列有關說法正確的是( )
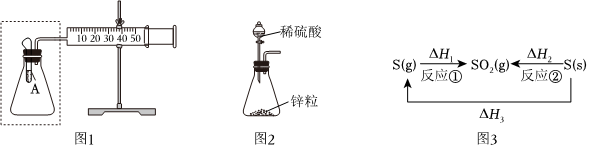
A.向圖1的試管A中加入某一固體和液體,若注射器的活塞右移,說明A中發(fā)生了放熱反應 B.將圖1虛框中的裝置換為圖2裝置,若注射器的活塞右移,說明鋅粒和稀硫酸的反應為放熱反應 C.由圖3可知,反應①的△H1小于反應②的△H2 D.由圖3可知,△H3=△H1+△H2 組卷:27引用:3難度:0.5
二、非選擇題(本題包括4個小題,共60分)
-
 13.一定溫度下,向一容積為5L的恒容密閉容器中充入0.4mol SO2和0.2mol O2,發(fā)生反應:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol。當反應達到平衡時,容器內壓強變?yōu)槠鹗紩r的0.7倍。請回答下列問題:
13.一定溫度下,向一容積為5L的恒容密閉容器中充入0.4mol SO2和0.2mol O2,發(fā)生反應:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol。當反應達到平衡時,容器內壓強變?yōu)槠鹗紩r的0.7倍。請回答下列問題:
(1)判斷該反應達到平衡狀態(tài)的標志是(填字母)。
A.SO2、O2、SO3三者的濃度之比為2:1:2 B.容器內氣體的壓強不變
C.容器內混合氣體的密度保持不變 D.SO3的物質的量不再變化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的轉化率=;②達到平衡時反應放出的熱量為kJ;③此溫度下該反應的平衡常數K=。
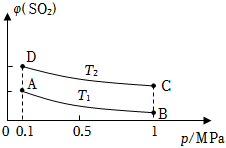
(3)圖表示平衡時SO2的體積分數隨壓強和溫度變化的曲線,則:
①溫度關系:T1T2(填“>”、“<”或“=”,下同);
②平衡常數關系:KAKB,KAKD。組卷:51引用:3難度:0.5 -
 14.(1)已知常溫時,0.1 mol/L醋酸在水中有0.1%發(fā)生電離,則該溶液的pH=醋酸的電離平衡常數K=
14.(1)已知常溫時,0.1 mol/L醋酸在水中有0.1%發(fā)生電離,則該溶液的pH=醋酸的電離平衡常數K=
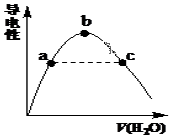
(2)向冰醋酸中逐滴加水,溶液導電性隨加入水的體積變化如圖所示:
①a、b、c三點溶液中CH3COOH的電離程度由大到小的順序是。
②a、c兩點對應的溶液分別吸收氨氣,若兩溶液最終pH均為7(25℃時),則a 點溶液中的c(CH3COO-)c點溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃時部分弱電解質的電離平衡常數數據如表所示,回答下列問題:
①物質的量濃度均為0.1mol/L的四種溶液:pH由小到大排列的順序是化學式 CH3COOH H2CO3 HClO 電離平衡常數 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8 (用編號填寫)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②寫出向次氯酸鈉溶液中通入少量二氧化碳的離子方程式:組卷:106引用:2難度:0.5


