2020-2021學年福建省福州四中高二(上)期中化學試卷
發布:2025/1/6 6:0:2
一、選擇題(本大題共20小題,每小題3分,共計60分。每小題只有一個正確選項)
-
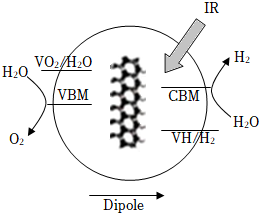 1.中國科學技術大學在光解水制氫(如圖)過程中巧妙地把納米制造技術和濕化學方法結合起來,首次揭開了硅材料“光解水制氫”機制的“神秘面紗”。光化學電池光解水制氫的能量轉化形式主要為( )
1.中國科學技術大學在光解水制氫(如圖)過程中巧妙地把納米制造技術和濕化學方法結合起來,首次揭開了硅材料“光解水制氫”機制的“神秘面紗”。光化學電池光解水制氫的能量轉化形式主要為( )A.化學能轉化為電能 B.化學能轉化為光能 C.光能轉化為化學能 D.電能轉化為光能 組卷:0引用:1難度:0.8 -
2.化學與人類生活、社會可持續發展密切相關,下列說法正確的是( )
A.直接燃燒煤和將煤進行深加工后再燃燒的效率相同 B.天然氣、水能屬于一級能源,水煤氣、電能屬于二級能源 C.人們可以把放熱反應釋放的能量轉化為其它可利用的能量,而吸熱反應沒有利用價值 D.地熱能、風能、天然氣和氫能都屬于新能源 組卷:45引用:6難度:0.7 -
3.下列敘述與電化學腐蝕有關的是( )
A.炒過菜的鐵鍋不及時清洗易生銹 B.在空氣中金屬鎂具有較好的抗腐蝕性 C.紅熱的鐵絲與水接觸時,表面形成了藍黑色的物質 D.把鐵片投入到氯化銅溶液中,在鐵表面上附著一層紅色的銅 組卷:4引用:3難度:0.7 -
4.用惰性電極分別電解下列各電解質的水溶液,一段時間后(設電解質足量),向電解后溶液中加入適量原電解質,可以使溶液恢復到電解前的濃度的是( )
A.Cu(NO3)2 B.K2SO4 C.HCl D.NaOH 組卷:23引用:6難度:0.9 -
5.下列圖示中關于銅電極的連接錯誤的是( )
A. 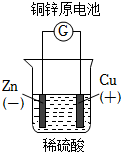
B. 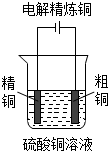
C. 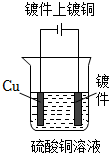
D. 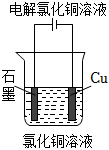 組卷:118引用:46難度:0.9
組卷:118引用:46難度:0.9 -
6.在恒溫恒容的容器里進行下列反應:N2+3H2?2NH3,其他條件不變,向容器中充入氬氣,則此反應速率會( )
A.變大 B.變小 C.不變 D.無法判斷 組卷:51引用:3難度:0.9 -
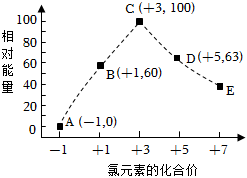 7.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )
7.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )A.A B.B C.C D.D 組卷:0引用:1難度:0.9 -
8.在測定中和熱的實驗中,下列說法正確的是( )
A.使用環形玻璃攪拌棒是為了加快反應速率,減小實驗誤差 B.為了準確測定反應混合溶液的溫度,實驗中溫度計水銀球應與小燒杯底部接觸 C.用0.5mol?L-1NaOH溶液分別與0.5mol?L-1的鹽酸、醋酸溶液反應,若所取的溶液體積相等,則測得的中和熱數值相同 D.在測定中和熱實驗中需要使用的儀器有容量瓶、量筒、燒杯、溫度計、環形玻璃攪拌棒 組卷:45引用:2難度:0.7
二、非選擇題(本大題共5小題,共40分)
-
24.飲用水中的NO3-主要來自NH4+.已知在微生物作用的條件下,NH4+經過兩步反應被氧化成NO3-.兩步反應的能量變化示意圖如下:
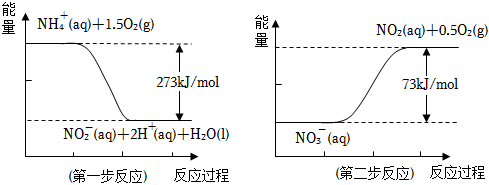
試寫出1molNH4+(aq)全部氧化成NO3-(aq)的熱化學方程式:。組卷:13引用:2難度:0.5 -
25.工業上可利用CO或CO2來生產燃料甲醇。已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示。
回答下列問題:化學反應 平衡常數 溫度 500℃ 700℃ 800℃ ①2H22(g)+CO(g)?CH3OH(g) K1 2.5 0.34 0.15 ②H2(g)+CO2(g)?H2O(g)+CO(g) K2 1 1.7 2.52 ③3H2(g)+CO2(g)?CH3OH (g)+H2O(g) K3
(1)判斷反應①是(填“吸熱”或“放熱”)反應。
(2)根據反應①、②可推導出K1、K2與K3之間的關系,則K3=(用含K1、K2的代數式表示)。
(3)某溫度下反應①中各物質的平衡濃度符合下式:20c(CH3OH)=3c(CO)?c2(H2)。試判斷此時的溫度為.
(4)500℃時測得反應③在某時刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的濃度分別為0.4mol?L-1、1mol?L-1、0.5mol?L-1、0.4mol?L-1,此時v正(填“>”“<”或“=”)v逆。
(5)500℃時,在2L密閉容器中加入2mol H2和amol CO2進行②的反應,反應5min后達到平衡,平衡時CO2的轉化率為50%,則a=mol,用H2表示該反應達到平衡時的平均反應速率v(H2)=mol?L-1?min-1。組卷:2引用:1難度:0.5


