2020-2021學年安徽省合肥市新東方學校高二(下)月考化學試卷0004
發(fā)布:2025/1/6 6:30:3
一、單項選擇題,(共計18小題)
-
1.下列事實不屬于鹽類水解應用的是( )
A.向FeCl3溶液中加入NaOH溶液產生紅褐色沉淀 B.實驗室常用熱的純堿溶液去除油污 C.實驗室配制FeCl3溶液時加入少量稀鹽酸 D.農業(yè)生產中草木灰與銨態(tài)化肥不能混合使用 組卷:28引用:1難度:0.7 -
2.下列化學用語正確的是( )
A.醋酸銨在水溶液中電離:CH3COONH4?CH3COO-+NH4+ B.碳酸氫鈉在水溶液中電離:NaHCO3═Na++H++CO32- C.Na2S溶液顯堿性:S2-+H2O?H2S+OH- D.CuSO4溶液顯酸性:Cu2++2H2O?Cu(OH)2+2H+ 組卷:21引用:1難度:0.8 -
3.設NA為阿伏加德羅常數(shù)的值,下列敘述正確的是( )
A.0.1mol14C中,含有0.6NA個中子 B.含NA個CO32-的Na2CO3溶液中,Na+數(shù)目為2NA C.一定條件下,將1molN2與3molH2充入一密閉容器內充分反應后,容器內氣體分子數(shù)為2NA D.向含有FeI2的溶液中通入適量氯氣,當有1molFe2+被氧化時,反應中轉移電子的數(shù)目至少為3NA 組卷:15引用:1難度:0.8 -
4.下列事實不能證明HNO2是弱電解質的是( )
A.滴入酚酞試液,NaNO2溶液顯紅色 B.測定0.10mol?L-1HNO2溶液的pH=2 C.用HNO2溶液做導電實驗,燈泡很暗 D.HNO2溶液中的微粒中有:HNO2、H+、NO3-、OH-、H2O 組卷:20引用:1難度:0.7 -
5.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.無色透明溶液:Al3+、K+、HCO3-、Cl- B.通入CO2后的溶液:Ca2+、Na+、NO3-、CH3COO- C.由水電離出的c(H+)=1.0×10-12mol?L-1溶液:Na+、NH4+、SO42-、F- D.c(Fe3+)=1.0mol?L-1的溶液:Mg2+、SCN-、SO42-、NO3- 組卷:37引用:1難度:0.7 -
6.常溫下,下列由水電離出的c(OH-)=1.0×10-10mol?L-1的溶液是( )
A.0.01mol?L-1的H2SO4溶液 B.0.01mol?L-1的NH3?H2O溶液 C.pH=10的Na2CO3溶液 D.pH=4的CH3COOH溶液 組卷:134引用:1難度:0.6 -
7.相同溫度,相同物質的量濃度的4種溶液:
①CH3COONa ②NaHSO4 ③NaCl ④C6H5ONa,
按pH由大到小的順序排列,正確的是( )A.④>①>③>② B.①>④>③>② C.①>②>③>④ D.④>③>①>② 組卷:92引用:3難度:0.7
二、填空題,(共計3大題)
-
20.鈦白粉(TiO2)在涂料、油墨等工業(yè)中有重要用途.實驗室利用金紅石(主要成分為TiO2,含有少量SiO2)制備鈦白粉并測定其質量分數(shù)的過程如下:
Ⅰ.制備TiCl4
利用反應TiO2(s)+CCl4(g)TiCl4(g)+CO2(g),在如圖裝置中制備TiCl4。△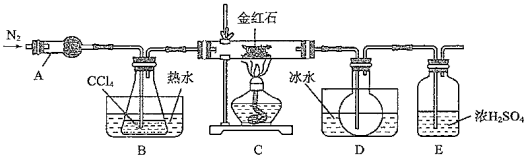
有關物質的性質如表。
(1)儀器A的名稱為物質 熔點/C 沸點/℃ 其它 CCl4 -23 76 與TiCl4互溶 TiCl4 -25 136 遇潮濕空氣產生白霧 SiCl4 -70 57.6 遇潮濕空氣產生白霧 。
(2)在組裝好儀器之后,首先進行的操作是;裝置E的主要作用是。
實驗結束后將D中燒瓶內的液態(tài)混合物分離的操作名稱是。
Ⅱ.制備鈦白粉
在TiCl4中加適量水,加熱得到沉淀TiO2?xH2O,然后過濾、水洗、烘干、焙燒得到鈦白粉.
(3)TiCl4水解生成TiO2?xH2O的化學方程式為。
Ⅲ.測定鈦白粉中TiO2的質量分數(shù)
(4)實驗步驟如下:
步驟一:將ag鈦白粉試樣溶于足量熱的硫酸,在隔絕空氣的條件下加入過量的鋁粉將Ti4+還原為Ti3+后過濾;
步驟二:配制0.100mol?L-11000mL硫酸鐵銨標準溶液。稱取48.2g硫酸鐵銨[NH4Fe(SO4)2?12H2O]于適量的稀硫酸中加熱溶解,,用蒸餾水洗滌燒杯與玻璃棒2~3次,并將洗滌液全部注入容量瓶中,向容量瓶中加蒸餾水至離刻度線1~2cm處,,再將容量瓶塞好瓶塞,反復上下顛倒,搖勻。
步驟三:加入幾滴KSCN溶液作指示劑,用配制的NH4Fe(SO4)2標準溶液滴定至終點(將Ti3+氧化為Ti4+),消耗NH4Fe(SO4)2溶液的體積VmL。
①補齊步驟二中實驗操作、。
②鈦白粉試樣中所含TiO2的質量分數(shù)表達式為。
③下列關于測定結果的分析,說法正確的是。(填字母)
a.若鈦白粉中含有少量鐵元素,將導致測定結果偏低
b.若步驟二中未洗滌燒杯和玻璃棒,將導致測定結果偏低
c.若步驟三滴定過程中速度過慢,將導致測定結果偏低組卷:12引用:2難度:0.5 -
21.氮的化合物在生產生活中廣泛存在。
(1)用焦炭還原NO的反應為:2NO(g)+C(s)?N2(g)+CO2(g),向容積均為1L的甲、乙、丙三個恒容恒溫(反應溫度分別為400℃、400℃、T℃)容器中分別加入足量的焦炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如表所示:
①該反應為t/min 0 40 80 120 160 n(NO)(甲容器)/mol 2.00 1.50 1.10 0.80 0.80 n(NO)(乙容器)/mol 1.00 0.80 0.65 0.53 0.45 n(NO)(丙容器)/mol 2.00 1.45 1.00 1.00 1.00 (填“放熱”或“吸熱”)反應,平衡常數(shù)的表達式為K=。
②乙容器在200min達到平衡狀態(tài),則0~200min內用NO的濃度變化表示的平均反應速率v(NO)=。
(2)用焦炭還原NO2的反應為:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒溫條件下,1molNO2和足量C發(fā)生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖1所示: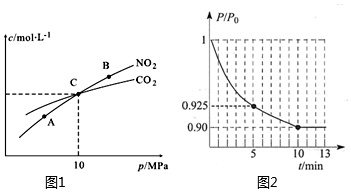
①A、B兩點的濃度平衡常數(shù)關系:Kc(A)Kc(B) (填“<”或“>”或“=”)。A、B、C三點中NO2的轉化率最高的是(填“A”或“B”或“C”)點。
②計算C點時該反應的壓強平衡常數(shù)Kp(C)=。(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數(shù))
(3)對于2NO(g)+2CO(g)?N2(g)+2CO2(g),在一定溫度下,于IL的恒容密閉容器中充入0.1molNO和0.3molCO,反應開始進行。
①下列能說明該反應已經達到平衡狀態(tài)的是(填字母代號)。
A.c(CO)═c(CO2)
B.容器中混合氣體密度不變
C.v(N2)正═2v(NO)逆
D.容器中混合氣體的平均摩爾質量不變
②圖2為容器內的壓強(P)與起始壓強(P0)的比值()隨時間(t)的變化曲線,曲線中的兩個點的坐標分別為(5,0.925)和(10,0.90)。平衡時NO的轉化率為PP0。組卷:6引用:1難度:0.5


