2022年天津市紅橋區高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項最符合題意,每小題3分,共36分)
-
1.2022北京冬奧會體現了綠色奧運、科技奧運.下列說法錯誤的是( )
A.火炬“飛揚”中使用純氫做燃料,實現碳排放為零 B.冬奧場館“冰絲帶”使用CO2制冰,比氟利昂更環保 C.領獎禮服中的石墨烯發熱材料屬于金屬材料 D.火炬燃料出口處有鈉鹽涂層,能使火焰呈明亮黃色 組卷:68引用:2難度:0.5 -
2.下列比較正確的是( )
A.原子半徑:N>C B.第一電離能:P>S C.堿性:AI(OH)3>Mg(OH)2 D.熱穩定性:HCl>HF 組卷:45引用:1難度:0.7 -
3.下列化學用語書寫不正確的是( )
A.氯原子的結構示意圖: 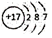
B.CO2的結構式:O=C=O C.苯的空間填充模型: 
D.基態Cr原子的價層電子軌道表示式: 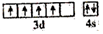 組卷:32引用:1難度:0.5
組卷:32引用:1難度:0.5 -
4.化學與生產、生活及環境密切相關.下列說法正確的是( )
A.過期藥品應投入可回收垃圾箱內 B.二氧化硫有毒,嚴禁將其添加到任何食品和飲料中 C.新冠變異病毒奧密克戎毒株中的蛋白質屬于高分子化合物 D.屠呦呦團隊用乙醚從黃花蒿中萃取青蒿素的過程,屬于化學變化 組卷:52引用:2難度:0.5 -
5.下列各組物質中,化學鍵類型相同,晶體類型也相同的是( )
A.C(金剛石)和CO2 B.NaBr和HBr C.Cl2和KCl D.CH4和H2O 組卷:145引用:14難度:0.9
二、非選擇題
-
15.某小組同學欲在實驗室中制備FeSO4并進行性質探究。
Ⅰ.FeSO4的制備:用活性鐵粉與硫酸反應制備FeSO4。
(1)寫出制備反應的離子方程式:。
(2)在制備過程中應確保鐵粉過量,結合化學用語解釋原因:。
Ⅱ.性質探究:將得到的FeSO4晶體配成溶液后進行如下實驗:
(3)依據“溶液變為紅色”的現象推斷Fe2+被氧化,推斷理由是序號 操作 實驗現象 實驗i 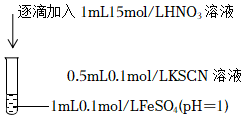
滴入硝酸后,溶液變為紅色,一段時間后,溶液褪為無色。 。
(4)針對溶液褪色的現象進行探究。預測可能原因是硝酸將SCN-氧化(其中C元素為+4價),為驗證預測,進行實驗ii:
補全反應:3SCN-+13NO3-+序號 操作 實驗現象 實驗ⅱ 取少量反應結束后的溶液滴加氯化鋇溶液 產生白色沉淀 ═+3CO2↑+16NO↑+。
(5)
開展進一步研究,進行實驗ⅲ、ⅳ。
①某同學依據實驗ⅲ的現象得出結論:該條件下,HNO3氧化Fe2+的速率比氧化SCN-的速率快,該結論是否合理,請說明理由序號 操作 實驗現象 實驗ⅲ 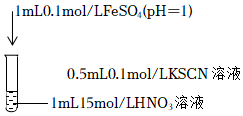
滴入FeSO4后,溶液變為紅色,靜置,t1時刻后溶液紅色恰好褪去。 實驗ⅳ 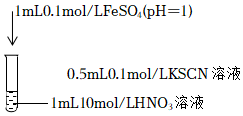
。
②對比實驗ⅲ、ⅳ現象得出結論:該條件下,在t1時刻內,HNO3濃度降低后,仍可氧化Fe2+,但不能氧化SCN-。實驗ⅳ的現象是。
Ⅲ.產品評價:選擇氧化還原滴定法來測定所得FeSO4?7H2O晶體中Fe2+的含量。
(6)稱量xg制得的樣品,加水溶解,并加入稀H2SO4酸化;用ymol/LKMnO4溶液滴定至終點,消耗KMnO4溶液zmL。滴定終點的實驗現象是。Fe2+的含量為。組卷:81引用:3難度:0.6 -
16.將CH4和CO2兩種引發溫室效應的氣體轉化為合成氣(H2和CO),可以實現能量綜合利用,對環境保護具有十分重要的意義.
(1)利用CH4、CO2在一定條件下重整的技術可得到富含CO的氣體,重整過程中的催化轉化原理如圖所示.
已知:i.CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1
ii.CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH2=+165kJmol-1
①過程I反應的化學方程式為.
②該技術總反應的熱化學方程式為.
③反應i甲烷含量隨溫度變化如圖1,圖中a、b、c、d四條曲線中的兩條代表壓強分別為1MPa、2MPa時甲烷含量曲線,其中表示2MPa的是.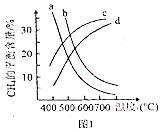
(2)甲烷的水蒸氣重整涉及以下反應
I.CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1
II.CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2=41kJ?mol-1
在一密閉體積可變容器中,通入1molCH4和3molH2O(g)發生甲烷的水蒸氣重整反應.
①反應I的平衡常數的表達式為.反應II平衡常數K(5000℃)K(700℃)(填“>”“<”或“=”).
②壓強為P0kPa時,分別在加CaO和不加CaO時,平衡體系H2的物質的量隨溫度變化如圖2所示.溫度低于700℃時,加入CaO可明顯提高混合氣中H2的量,原因是.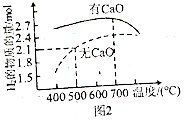 組卷:58引用:1難度:0.5
組卷:58引用:1難度:0.5


