2016-2017學年山東省棗莊市滕州三中高三(上)第三周周測化學試卷
發布:2024/4/20 14:35:0
一、選擇題
-
1.海洋中有豐富的“食品、礦產、能源、藥物和水產資源”等,下列說法正確的是( )

A.第①步中除去泥沙及Ca2+、Mg2+等雜質時,不涉及化學變化過程 B.工業上,通過電解“精鹽”水溶液可以制取金屬鈉 C.第②步的反應條件是“在空氣中直接加熱” D.第③、④、⑤步中均涉及氧化還原反應 組卷:303引用:6難度:0.7 -
2.固體A的化學式為NH5,它的所有原子的最外層都符合相應稀有氣體原子的最外電子層結構,則下列有關說法中,不正確的是( )
A.NH5中既有離子鍵又有共價鍵 B.NH5的熔、沸點高于NH3 C.NH5固體投入少量水中,可產生兩種氣體 D.0.1 mol NH5中含有5 mol N-H鍵 組卷:91引用:10難度:0.7 -
3.NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.一定條件下,1molN2和3molH2充分反應,生成物中的N-H鍵數目為6NA B.完全燃燒1.5molCH3CH2OH和C2H4的混合物,轉移電子數為18NA C.100g 98%的濃硫酸中含氧原子個數為4NA D.1L 0.1 mol/L的Na2S溶液中S2-和HS-的總數為0.1NA 組卷:28引用:7難度:0.9 -
4.常溫下,下列各組離子在指定溶液中,一定可以大量共存的是( )
A.無色溶液中 Mg2+、Al3+、 、SO2-4CO2-3B.pH=1的溶液中 、Ba2+、NH+4、HCO-3NO-3C.含 的溶液中 H+、K+、Br-、I-MnO-4D.在 =1×10-12的溶液中 Na+、K+、CH3COO-、c(H+)c(OH-)SO2-4組卷:16引用:3難度:0.7 -
5.由已知電離常數判斷,SO2與Na2CO3(aq)反應的離子方程式不合理的是( )
酸 電離常數 碳酸 Ki1=4.3×10-7
Ki2=5.6×10-11亞硫酸 Ki1=1.54×10-2
Ki2=1.02×10-7A.SO2+H2O+2CO32-→2HCO3-+SO32- B.SO2+H2O+CO32-→H2CO3+SO32- C.2SO2+2H2O+CO32-→H2CO3+2HSO3- D.SO2+H2O+CO32-→HCO3-+HSO3- 組卷:72引用:9難度:0.7 -
6.在硫酸鐵電化浸出黃銅礦精礦工藝中,有一主要反應:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反應結束后,經處理獲得單質硫x mol.下列說法正確的是( )
A.反應中硫元素被氧化,所有鐵元素均被還原 B.氧化劑是Fe3+,氧化產物是Cu2+ C.反應中轉移電子的物質的量為xmol D.反應結束后,測得溶液中三種金屬離子的總物質的量為ymol,則原Fe3+的總物質的量為(y-x)mol 組卷:211引用:21難度:0.9 -
7.根據表中信息判斷,下列選項正確的是( )
序號 反應物 產物 ① KMnO4、H2O2、H2SO4 K2SO4、MnSO4… ② Cl2、FeBr2 FeCl3、FeBr3 ③ MnO4-… Cl2、Mn2+… A.第①組反應的其余產物為H2O、MnSO4 B.第②組反應中Cl2與FeBr2的物質的量之比小于或等于1:2 C.第③組反應中生成1mol Cl2,轉移電子5mol D.氧化性由強到弱順序為MnO4->Cl2>Fe3+>Br2 組卷:12引用:1難度:0.7 -
8.Cu2S與一定濃度的HNO3反應,生成Cu(N O3 )2、CuSO4、NO2、NO和H2O.當NO2和NO的體積相等時,實際參加反應的Cu2S與HNO3的物質的量之比為( )
A.1:7 B.1:5 C.1:9 D.2:9 組卷:204引用:10難度:0.9
三、實驗題
-
23.由Fe2O3、Fe、CuO、C、Al中的幾種物質組成的混合粉末,取樣品進行下列實驗(部分產物略去):
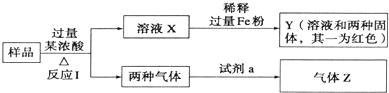
(1)取少量溶液X,加入過量的NaOH溶液,有沉淀生成.取上層清液,通入CO2,無明顯變化,說明樣品中不含有的物質是(填寫化學式).
(2)Z為一種或兩種氣體
①若Z只為一種氣體,試劑a為飽和NaHCO3溶液,則反應Ⅰ中能同時生成兩種氣體的化學方程式是.
②若Z為兩種氣體的混合物,試劑a為適量水,則Z中兩種氣體的化學式是.
(3)向Y中通入過量氯氣,并不斷攪拌,充分反應后,溶液中的陽離子是(填寫離子符號).
(4)取Y中的溶液,調pH約為7,加入淀粉KI溶液和H2O2,溶液呈藍色并有紅褐色沉淀生成.當消耗2mol I-時,共轉移3mol電子,該反應的離子方程式是.組卷:58引用:9難度:0.3 -
24.實驗室需要0.2mol?L-1CuSO4溶液250mL,實驗室除蒸餾水外還提供藍色膽礬晶體(CuSO4?5H2O)和4mol?L-1 CuSO4溶液兩種試劑以配制該溶液.
(1)無論采用何種試劑進行配制,實驗必須用到的玻璃儀器除燒杯、玻璃棒、膠頭滴管外,至少還需要的一種儀器是,在使用該儀器前必須進行的操作是.
(2)若用膽礬晶體進行配制,需要托盤天平稱取CuSO4?5H2O的質量為g;如果用4mol?L-1的CuSO4溶液配制,需用量筒量取mL 4mol?L-1 CuSO4溶液.
(3)用4mol?L-1的CuSO4溶液配制溶液所需的實驗步驟有:
a.往燒杯中加入約100mL水進行初步稀釋,冷卻至室溫
b.用量筒量取一定體積4mol?L-1的CuSO4溶液于一燒杯中
c.計算所需4mol?L-1的CuSO4溶液的體積
d.蓋好瓶塞,反復上下顛倒搖勻后,將溶液轉存于試劑瓶中
e.加水至液面離容量瓶刻度線1~2cm處,改用膠頭滴管進行定容
f.洗滌燒杯和玻璃棒2~3次并將洗滌液注入容量瓶,輕輕搖動容量瓶,使溶液混合均勻
g.將溶液轉移入容量瓶
其中正確的操作順序為.
(4)指出配制過程中的以下情形對所得溶液濃度的影響(填“偏大”、“偏小”或“無影響”).
①d步驟搖勻后發現液面低于刻度線,再加蒸餾水至刻度線:;
②e步驟中,俯視刻度線:;
③g步驟前,容量瓶未干燥,有少量蒸餾水:.組卷:152引用:6難度:0.5


