2013-2014學年山東省威海市乳山一中高三(上)第一次月考化學試卷(10月份)
發布:2024/4/20 14:35:0
一、選擇題(本題包括16小題,每題3分,共48分.每小題只有一個選項符合題意)
-
1.下列說法中不正確的是( )
A.Na2O2、HClO、SO2等物質都具有漂白作用 B.液氨、液態氯化氫都是電解質 C.置換反應都是氧化還原反應,復分解反應都是非氧化還原反應 D.明礬能水解生成氫氧化鋁膠體,可用作凈水劑 組卷:7引用:3難度:0.9 -
2.下列說法不正確的是( )
A.做CO還原CuO的實驗時,尾氣用點燃的方法除去 B.FeCl2、Na2O2、Fe(OH)3均可通過化合反應生成 C.金屬鈉、鉀起火,可用泡沫滅火器滅火 D.“水滴石穿”是因為溶解了CO2的雨水與CaCO3作用生成Ca(HCO3)2 組卷:43引用:1難度:0.9 -
3.設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A.標準狀況下,22.4 L 苯中含有NA個苯分子 B.1 mol/L NaCl溶液含有NA個Na+ C.1 mol Fe和足量稀硝酸反應產生22.4LNO D.16 g CH4中含有4 NA個C-H鍵 組卷:15引用:1難度:0.9 -
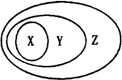 4.下表各組物質或概念之間,不符合圖所示關系的是( )
4.下表各組物質或概念之間,不符合圖所示關系的是( )
X Y Z A 硫酸 含氧酸 酸 B 膠體 分散系 混合物 C 電解質 化合物 純凈物 D 置換反應 氧化還原反應 離子反應 A.A B.B C.C D.D 組卷:18引用:5難度:0.9 -
5.下列各組離子在指定溶液中能大量共存的是( )
A.無色溶液中:K+、Na+、 、MnO-4SO2-4B.含大量Fe2+溶液中:K+、Cl-、 、Na+NO-3C.加入Al能放出H2的溶液中:Cl-、 、HCO-3、SO2-4NH+4D.在酸性溶液中:Ba2+、Na+、 、Cl-SO2-4組卷:9引用:8難度:0.7 -
6.下列與實驗相關的敘述正確的是( )
A.鈉在氯氣中燃燒,產生白色的煙霧 B.除去NaHCO3溶液中混有的少量Na2CO3,可加入適量的NaOH C.配制溶液時,若加水超過容量瓶刻度,應該重新配制 D.檢驗某溶液是否含有SO42-時,應取少量該溶液,依次加入BaCl2溶液和稀鹽酸 組卷:41引用:1難度:0.9 -
7.下列實驗設計能完成預期實驗目的是( )
選項 實驗目的 實驗設計 A 配制10%的ZnSO4 將10g ZnSO4?7H2O溶解于90g水中 B 配制100ml,濃度約為1mol/L的氯化鈉溶液 用托盤天平稱量5.85g氯化鈉固體,轉移至燒杯,加入100ml蒸餾水,攪拌溶解 C 驗證二氧化硫的漂白性 將二氧化硫氣體通入品紅溶液,溶液褪色 D 取出分液漏斗中所需的上層液體 下層液體從分液漏斗下端管口放出,關閉活塞,換一個接收器,上層液體繼續從分液漏斗下端管口放出 A.A B.B C.C D.D 組卷:14引用:8難度:0.7
二、解答題(共5小題,滿分52分)
-
 20.如圖是硫酸試劑瓶標簽上的內容
20.如圖是硫酸試劑瓶標簽上的內容
(Ⅰ)該硫酸的物質的量濃度是mol/L
( II)某化學興趣小組進行硫酸性質的實驗探究時,需要240mL
1.84mol/L的稀硫酸.
可供選擇的儀器有:①玻璃棒 ②燒瓶 ③燒杯 ④膠頭滴管
⑤量筒 ⑥容量瓶 ⑦托盤天平 ⑧藥匙
請回答下列問題:
(1)上述儀器中,在配制稀硫酸時用不到的有(填代號)
(2)經計算,需濃硫酸的體積為.現有①10mL②50mL③100mL三種規格的量筒,你選用的量筒是(填代號)將上述硫酸進行稀釋的實驗操作為.
(3)在配制稀硫酸過程中,其他操作都準確,能引起誤差偏高的有(填代號)
①洗滌量取濃硫酸的量筒,并將洗滌液轉移到容量瓶中
②容量瓶用1mol/L稀硫酸潤洗
③轉移前,容量瓶中含有少量蒸餾水
④量取濃硫酸時俯視讀刻度.組卷:28引用:2難度:0.5 -
21.某煉鐵廢渣中含有大量的CuS及少量鐵的氧化物,工業上以該廢渣和NaCl為原料生產CuCl2?2H2O晶體,其工藝流程中主要涉及焙燒、尾氣處理、酸浸、調控溶液pH、過濾、蒸發結晶等.焙燒過程中發生的主要反應為:CuS+2NaCl+2O2═CuCl2+Na2SO4
請回答下列問題:
(1)焙燒時還有廢氣產生,其中一種是主要的大氣污染物.若在實驗室中以堿液吸收處理之,下列A、B、C裝置中可行的是(填字母);若選用甲裝置,則燒杯中的下層液體可以是.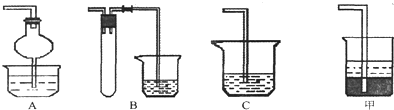
(2)調控溶液pH時采用pH試紙來測定溶液的pH,則正確的操作方法是.
(3)若最后所得的濾液中的陰離子只有SO42-和Cl-,則檢驗濾液中這兩種離子的實驗操作為、.組卷:15引用:3難度:0.5


