2021-2022學(xué)年重慶市涪陵實(shí)驗(yàn)中學(xué)高三(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(每小題3分,共42分)
-
1.古詩詞或諺語中包含了豐富的化學(xué)知識(shí),下列說法正確的是( )
選項(xiàng) 古詩詞或諺語 涉及的化學(xué)反應(yīng)類型 A 熬膽礬鐵釜,久之亦化為銅 復(fù)分解反應(yīng) B 千錘萬鑿出深山,烈火焚燒若等閑 分解反應(yīng) C 美人首飾侯王印,盡是江中浪底來 置換反應(yīng) D 真金不怕火,怕火便是銅 分解反應(yīng) A.A B.B C.C D.D 組卷:17引用:3難度:0.7 -
2.下列有關(guān)實(shí)驗(yàn)的說法正確的是( )
A.氧化亞鐵可用作紅色油漆和涂料 B.二氧化硅可以做半導(dǎo)體材料 C.金屬鈉可保存在煤油中,也可保存在CCl4中 D.氧化鋁熔點(diǎn)高,可用于制造耐火坩堝 組卷:16引用:1難度:0.8 -
3.下列變化過程沒有涉及氧化還原反應(yīng)的是( )
A.打磨過的鋁箔加熱熔化但不滴落 B.Fe(OH)2白色沉淀在空氣中放置變成紅褐色 C.Na2O2加入水中,產(chǎn)生的氣體使帶火星的木條復(fù)燃 D.向Na2CO3飽和溶液中通入CO2,有晶體析出 組卷:2引用:1難度:0.7 -
4.下列說法中正確的是( )
A.金屬鈦密度小、硬度大、熔點(diǎn)高且抗腐蝕性能強(qiáng),可用于飛機(jī)、火箭等航天領(lǐng)域 B.因?yàn)镹a2CO3能與鹽酸反應(yīng),所以可用于治療胃酸過多 C.FeCl3溶液能與Cu反應(yīng),說明Fe的還原性強(qiáng)于Cu D.玻璃、光導(dǎo)纖維和陶瓷都是傳統(tǒng)硅酸鹽材料 組卷:7引用:1難度:0.7 -
5.有機(jī)物
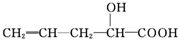 在不同條件下至少可能發(fā)生7種不同類型的反應(yīng):①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦縮聚,其中由于其分子結(jié)構(gòu)中含有-OH,可能發(fā)生的反應(yīng)有( )
在不同條件下至少可能發(fā)生7種不同類型的反應(yīng):①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦縮聚,其中由于其分子結(jié)構(gòu)中含有-OH,可能發(fā)生的反應(yīng)有( )A.②④⑥⑦ B.③④⑤⑥ C.②③④⑤ D.①③④⑤⑦ 組卷:11引用:3難度:0.7 -
6.下列選用的儀器和藥品能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?br />
A B C D 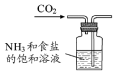
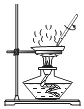
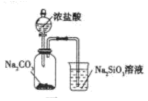
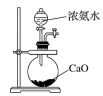
實(shí)驗(yàn)室制備少量碳酸氫鈉 實(shí)驗(yàn)室灼燒氫氧化鋁 驗(yàn)證酸性:鹽酸>碳酸>硅酸 實(shí)驗(yàn)室制備少量氨氣 A.A B.B C.C D.D 組卷:3引用:2難度:0.5
二、解答題(共4小題,滿分58分)
-
17.鎢是我國的豐產(chǎn)元素,是熔點(diǎn)最高的金屬,廣泛用于拉制燈泡的燈絲,鎢在自然界主要以鎢(W)酸鹽的形式存在。有開采價(jià)值的鎢礦石之一白鎢礦的主要成分是CaWO4,含有SiO2、Fe2O3等雜質(zhì),工業(yè)冶煉鎢的流程如圖:
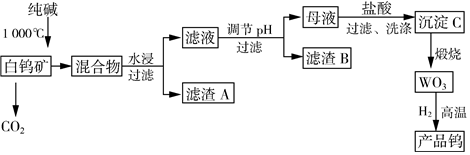
已知:
①鎢酸(H2WO4)酸性很弱,難溶于水
②離子完全沉淀的pH:為8,SiO2-3為5WO2-4
③碳和金屬鎢在高溫下會(huì)反應(yīng)生成碳化鎢
(1)為加快水浸的速率,可采取等措施(任寫一條);濾渣B的主要成分是(寫化學(xué)式)。
(2)CaWO4與純堿發(fā)生的化學(xué)反應(yīng)方程式為。
(3)調(diào)節(jié)pH的適宜范圍是,調(diào)節(jié)pH可選用的試劑是(填字母序號)。
A.氨水
B.鹽酸
C.氫氧化鈉溶液
D.碳酸鈉溶液
(4)檢驗(yàn)沉淀C已洗滌干凈的具體操作是。
(5)根據(jù)鋁熱反應(yīng)的原理可以用WO3制取鎢,化學(xué)方程式為;為了獲得可以拉制燈絲的高純度金屬鎢,不宜用碳而必須用氫氣作還原劑的原因是。組卷:10引用:1難度:0.4 -
18.某課題組以苯為主要原料,采取以下路線合成利膽藥--柳胺酚。回答下列問題:
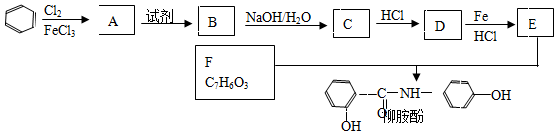
已知: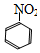 FeHCl
FeHCl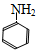
(1)對于柳胺酚,下列說法正確的是
A.1mol柳胺酚最多可以和2molNaOH反應(yīng) B.不發(fā)生硝化反應(yīng)
C.可發(fā)生水解反應(yīng) D.可與溴發(fā)生取代反應(yīng)
(2)寫出A→B反應(yīng)所需的試劑。
(3)寫出B→C的化學(xué)方程式。
(4)寫出化合物F的結(jié)構(gòu)簡式。
(5)寫出同時(shí)符合下列條件的F的兩種同分異構(gòu)體的結(jié)構(gòu)簡式。
①屬酚類化合物,且苯環(huán)上有三種不同化學(xué)環(huán)境的氫原子;
②能發(fā)生銀鏡反應(yīng)
(6)以苯和乙烯為原料可合成聚苯乙烯,請?jiān)O(shè)計(jì)合成路線(無機(jī)試劑及溶劑任選)。
注:合成路線的書寫格式參照如下示例流程圖:
CH3CHOCH3COOHO2催化劑CH3COOCH2CH3。CH3CH2OH濃H2SO4組卷:40引用:5難度:0.5


