2016-2017學年江蘇省常州市鐘樓實驗中學九年級(下)周末化學作業(4.21)
發布:2024/4/20 14:35:0
一、選擇題(共9小題,每小題3分,滿分27分)
-
1.有反應:8A+3B2=C2+6D(其中A、D是化合物,B2、C2是單質).若13.6g A與21.3g B2恰好完全反應,生成32.1g D,已知C2的相對分子質量為28,則B的相對原子質量為( )
A.14 B.16 C.32 D.35.5 組卷:565引用:35難度:0.5 -
2.在“綠色化學工藝”中,最好是反應物中原子全部轉化為欲制得的產物,即原子的利用率為100%.在用C3H4(丙炔)合成C5H8O2(2-甲基丙烯酸甲酯)的過程中,欲使原子的利用率達到最高,在催化劑作用下還需要其他的反應物是( )
A.CO和CH3OH B.CO2和H2O C.H2和CO D.CH3OH和H2 組卷:644引用:18難度:0.5 -
3.向AgNO3、Cu(NO3)2的混合溶液中加入一定量的鐵粉,充分反應后有金屬析出,過濾、洗滌后向濾渣中加入稀鹽酸,有無色氣體放出,則濾液中一定存在的物質是( )
A.Fe(NO3)3 B.Cu(NO3)2、Fe(NO3)2 C.Fe(NO3)2 D.AgNO3、Cu(NO3)2、Fe(NO3)2 組卷:214引用:27難度:0.7 -
4.下列數軸表示正確的是( )
A. 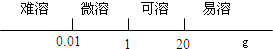
B. 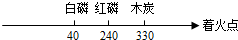
C. 
D.  組卷:20引用:3難度:0.9
組卷:20引用:3難度:0.9
二、非選擇題:
-
12.疊氮化鈉(NaN3)被廣泛應用于汽車安全氣囊,某興趣小組對其進行下列研究。
【應用研究】
(1)汽車經撞擊后,30毫秒內引發NaN3,迅速分解為Na、N2,反應方程式為。
【制備研究】
(2)將金屬鈉與液態氨反應得NaNH2,再將NaNH2與N2O反應可生成NaN3、NaOH和氣體X,該反應的化學方程式為2NaNH2+N2O=NaN3+NaOH+X,實驗室檢驗X氣體使用的試紙是濕潤。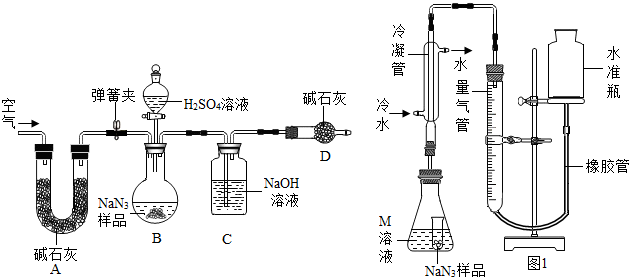
【Na2CO3質量分數測定】
工業級NaN3中常含有少量的Na2CO3,為測定樣品中Na2CO3的質量分數設計如圖1裝置(已知H2SO4溶液與NaN3,反應不生成氣體)。
(3)裝置A的作用是。設計的實驗步驟為:①精確稱量樣品,檢查裝置氣密性;②打開彈簧夾,鼓入空氣,稱量裝置C;③關閉彈簧夾,打開分液漏斗活塞;④再打開彈簧夾,;⑤再次稱量裝置C。
計算碳酸鈉含量至少需要測定(填數字)個數據。根據制備反應,分析工業級NaN3中含有Na2CO3的可能原因。
【NaN3純度測定】
精確稱量0.140g NaN3樣品,設計如圖2裝置,測定其純度。已知2NaN3→3N2(NaN3中的N全部轉化為N2,其他產物略),反應中放出大量的熱。
(4)檢查該裝置氣密性的方法是連接好裝置,從水準瓶注水,量氣管中液面與右邊液面形成高度差,做好標記,一段時間后,兩邊高度差(填“變大”、“變小”或“不變”),說明氣密性良好。
(5)使小試管中的NaN3樣品與M溶液接觸的操作是。
(6)使用冷水冷凝的目的是。反應前應將液面調節到量氣管的“0”刻度,并使兩邊液面相平,反應后讀數時,還需要進行的操作是。
(7)常溫下測得量氣管讀數為67.2mL(N2的密度為1.25g/L),則實驗中選用的量氣管規格合適的是(填字母序號)。
A.100mL B.1L C.2L
(8)計算NaN3樣品的純度(寫出計算過程)。組卷:102引用:4難度:0.3 -
13.已知木炭還原氧化銅實驗中發生的主要反應:C+2CuO
2Cu+CO2↑,某化學興趣小組對該實驗紅色固體產物的成分(假設反應物已完全反應)作如下探究:高溫
探究一:檢驗紅色固體產物的成分
【查閱資料】Ⅰ.木炭還原氧化銅除生成銅外還可能生成氧化亞銅(Cu2O);
Ⅱ.Cu和Cu2O均為不溶于水的紅色固體;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出問題】該實驗的紅色固體產物中含有什么物質?
【猜想與假設】假設1:紅色固體只含Cu; 假設2:紅色固體只含Cu2O;
假設3:(請補充完成假設3)。
【實驗探究】(填寫表中空格)
探究二:測定該實驗紅色固體產物中Cu2O的含量實驗操作 實驗現象 實驗結論 取少量紅色固體加入到足量稀硫酸溶液中 若無明顯現象 假設1成立 若固體 (選填“全部”或“部分”)溶解,溶液由無色變藍色假設2和假設3均成立
該化學興趣小組經交流討論后,設計了如下兩方案:
【方案一】稱取5.00g紅色固體加入到足量稀硫酸溶液中使其充分反應后,操作A、洗滌、干燥,稱量得紅色固體質量為4.10g。
(1)操作A的名稱是,在實驗室中完成操作A的玻璃儀器有玻璃棒、燒杯和;
(2)檢驗反應后剩余紅色固體是否洗滌干凈的方法是:取少量最后一次洗滌液,加入溶液,如果觀察到現象:,說明已洗滌干凈。
(3)通過計算,假設3成立,紅色固體產物中Cu2O的含量為;
【方案二】稱取5.00g的紅色固體,用如圖所示裝置進行實驗(固定裝置略去,堿石灰為氧化鈣和氫氧化鈉的混合物),通過測定反應前后裝置d的質量達到實驗目的。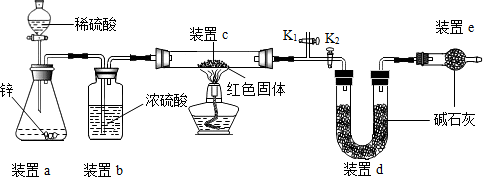
(1)裝置a中用稀硫酸而不用稀鹽酸,原因是;
(2)裝置b的作用是,若不加裝置b,實驗結果會(“偏大”或“偏小”);
(3)裝置c中涉及的反應化學方程式;
(4)裝置e的作用是,若不加裝置e,實驗結果會(“偏大”或“偏小”);
(5)點燃酒精燈前涉及的部分操作如下,
①連接儀器; ②;
③關閉K2,打開K1,通氫氣一段時間以趕盡裝置內原有的空氣,其目的是:①防止空氣中的H2O和CO2進入裝置d干擾測定;②防止,檢驗空氣是否趕盡的方法是:在K1處用小試管收集氣體,進行;④打開K2,關閉K1
(6)經測定反應前后裝置d的質量分別為100.00g、100.18g,計算產物中Cu2O的含量(寫出計算過程,最后結果保留小數點后1位);
【交流與反思】
(1)在方案一實驗測定中,若測定結果偏大,則下列可能的原因有。(填序號)
①反應后剩余紅色固體未洗滌干凈 ②洗滌后未完全干燥
③干燥方法采用的是在空氣中加熱烘干 ④稱量剩余紅色固體時,有部分固體灑落到實驗臺上
(2)方案二中利用同樣的裝置,還可通過測定反應前后裝置(填“a”、“b”或“c”)的質量達到實驗目的。組卷:43引用:1難度:0.3


