2021-2022學年福建省福州一中高二(上)期末化學試卷
發布:2024/11/15 7:0:2
一.選擇題(每題只有一個選項是正確的,每題3分,共45分,請將答案填涂在答題卷上。)
-
1.化學在日常生活和生產中有著重要的應用。下列說法不正確的是( )
A.冰在室溫下自動融化成水,是熵增的重要結果 B.明礬水解形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化 C.某雨水樣品采集后放置一段時間,pH由4.68變為4.28是因為溶液中 發生水解SO2-3D.醋酸鈉溶液呈堿性的原因是CH3COO-+H2O?CH3COOH+OH- 組卷:16引用:2難度:0.7 -
2.常溫下,下列溶液中各組離子一定能大量共存的是( )
A.在由水電離出的c(OH-)=10?13mol?L?1的溶液中:Na+、Mg2+、Cl-、I- B.0.1mol?L-1Na2S溶液:K+、 、NH+4、Al3+NO-2C.0.2mol?L-1的H2SO4溶液:Mg2+、Fe2+、 、Cl-NO-3D.澄清透明的溶液中:Fe3+、Mg2+、Br-、Cl- 組卷:98引用:6難度:0.6 -
 3.已知在含有少量I-的溶液中H2O2分解的機理為
3.已知在含有少量I-的溶液中H2O2分解的機理為
反應Ⅰ:H2O2(aq)+I-(aq)?IO-(aq)+H2O(l)ΔH1
反應Ⅱ:H2O2(aq)+IO-(aq)?O2(g)+I-(aq)+H2O(l)ΔH2
在一定溫度下,其反應過程能量變化如圖所示,下列有關該反應的說法不正確的是( )A.反應Ⅱ高溫下能自發進行 B.決定整個反應速率快慢的步驟是反應1 C.總反應是放熱反應 D.加入催化劑可以降低活化能,活化分子百分比雖然沒變,但可以加快反應速率 組卷:23引用:2難度:0.5 -
4.關于下列各裝置圖的敘述不正確的是( )
A. 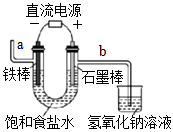
如圖裝置中a導管釋放出的氣體具有可燃性B. 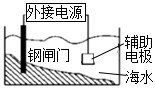
如圖裝置中鋼閘門應與外接電源的負極相連,稱之為“犧牲陽極的陰極保護法”C. 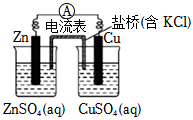
如圖裝置鹽橋中KCl的K+向右側燒杯移動D. 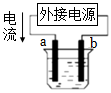
用如圖裝置精煉銅,b極為精銅,電解質溶液為CuSO4溶液組卷:16引用:1難度:0.7 -
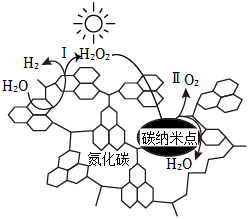 5.碳量子點是種新型碳納米材料,我國化學家研究的一種新型復微合光催化劑[碳量子點/氮化碳(納米復合物)]可以利用太陽光實現高效分解水,其原理如圖所示。下列說法正確的是( )
5.碳量子點是種新型碳納米材料,我國化學家研究的一種新型復微合光催化劑[碳量子點/氮化碳(納米復合物)]可以利用太陽光實現高效分解水,其原理如圖所示。下列說法正確的是( )A.復合光催化反應過程中實現了電能到化學能的轉化 B.水分解過程中,H2O2作催化劑 C.若反應Ⅱ是放熱反應,則反應Ⅰ一定是吸熱反應 D.總反應為2H2O2═2H2+O2 組卷:18引用:2難度:0.7 -
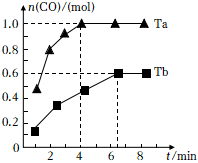 6.已知反應CH4(g)+H2O(g)?CO(g)+3H2(g)。向體積為2L的恒容密閉容器中通入1.5molCH4(g)和1.5molH2O(g),在不同溫度(Ta、Tb)下測得容器中n(CO)隨時間變化曲線如圖。下列說法正確的是( )
6.已知反應CH4(g)+H2O(g)?CO(g)+3H2(g)。向體積為2L的恒容密閉容器中通入1.5molCH4(g)和1.5molH2O(g),在不同溫度(Ta、Tb)下測得容器中n(CO)隨時間變化曲線如圖。下列說法正確的是( )A.Ta<Tb B.該反應是放熱反應 C.Tb時,CH4的平衡轉化率是60% D.Ta時,平衡后體系的壓強為起始壓強的 53組卷:23引用:1難度:0.5
二、非選擇題(共55分,須將答案填寫在答案卷上)
-
18.O2對人類有著重要的作用。請回答下列問題:
(1)甲醇是一種綠色可再生能源,已知熱化學方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g)ΔH1=-566.0kJ?mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g)ΔH2=-483.0kJ?mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g)ΔH3=-574.0kJ?mol-1
則計算CH3OH(g)+O2(g)=CO2(g)+2H2O(g)的ΔH=32。
(2)人體內化學反應時刻需要O2參與,如肌肉中的肌紅蛋白(Mb),具有結合O2的能力,可表示為Mb(aq)+O2(g)?MbO2(aq)。肌紅蛋白的結合度(即轉化率α)與平衡時的氧氣分壓p(O2)密切相關,其變化曲線如圖1。已知K=(氣體和溶液中的溶質分別用分壓和物質的量濃度表達)。c(MbO2)c(Mb)?p(O2)
①37℃時,已知平衡常數K=2,測得人正常呼吸時α的最大值為98%,則空氣中氧氣分壓p(O2)=kPa。
②血紅蛋白Hb結合O2形成動脈血,存在反應1:HbH+(aq)+O2(g)?HbO2(aq)+H+(aq)。血液中還同時存在反應2:CO2+H2O?H++HCO3-,結合兩個反應,肺部氧分壓(填“較高”或“較低”)有利于CO2排出體外。請你從平衡移動的角度解釋原因。
(3)游泳池水質普遍存在尿素[CO(NH2)2]超標現象,一種電化學除游泳池中尿素的實驗裝置如圖2所示,其中釕鈦常用作析氯電極,本身不參與電解。已知:3NaClO+CO(NH2)2=3NaCl+2H2O+N2↑+CO2↑。
①氮原子的核外電子排布式;
②電解過程中釕鈦電極上發生反應為;
③電解過程中不銹鋼電極附近pH(填“降低”“升高”或“不變”)
④標準狀況下,電解過程中每逸出22.4LN2,電路中至少通過電子數目。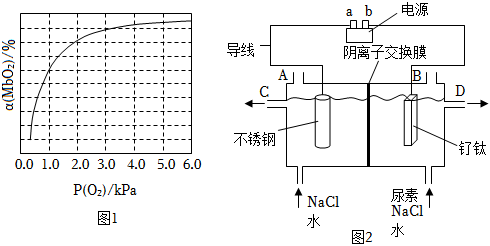 組卷:54引用:1難度:0.3
組卷:54引用:1難度:0.3 -
19.Ⅰ.高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素)制備,工藝如圖所示。
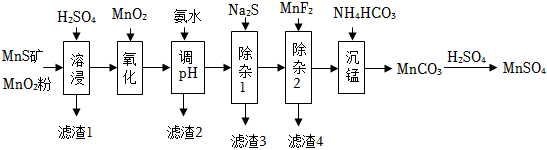
已知:①“濾渣1”含有S和SiO2;
②相關金屬離子初始濃度c(Mn+)=0.1mol?L-1形成氫氧化物沉淀的pH范圍如表所示:
回答下列問題:金屬離子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 開始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)“溶浸”過程中,提高浸出率的措施有(寫一條即可)。
(2)“氧化”中添加適量的MnO2的作用是。
(3)“除雜1”的目的是除去Zn2+和Ni2+,“濾渣3”的主要成分是。
(4)“調pH”的目的是除鐵和鋁,則溶液的pH范圍應調節為~6之間。
(5)“沉錳”時會產生無色無味的一種氣體,寫出“沉錳”的離子方程式。
Ⅱ.我國規定生活用水中鉛排放的最大允許濃度為0.0100mg?L-1。常溫下常見鉛鹽的溶度積常數如表所示:
(6)根據以上表格,為達到飲用水標準最佳的沉淀試劑應選擇下列物質中的化學式 PbSO4 PbI2 PbCO3 PbCrO4 PbS Ksp 1.80×10-8 8.50×10-9 1.50×10-13 1.80×10-14 9.00×10-29 。
A.Na2SO4
B.KI
C.Na2CO3
D.K2CrO4
E.Na2S
(7)按以上選擇的試劑,使1.00L飲用水達到國家排放標準,至少應該調節溶液中該沉淀試劑的陰離子濃度保持在之上。組卷:53引用:3難度:0.3


