2012-2013學年江西省贛州市信豐中學高二(上)周練化學試卷(一)
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題包括12小題,每小題5分,共70分).
-
1.我國擁有較豐富的地熱資源,其開發(fā)利用前景廣闊.下列關(guān)于地熱能說法正確的是( )
①可以用于洗浴、發(fā)電以及供暖等方面
②與煤炭、石油、天然氣一樣都是化石資源
③主要源于地球內(nèi)部放射性元素衰變產(chǎn)生的能量
④與地下水結(jié)合可形成熱水型,釋放形式之一是溫泉.A.①②③ B.①②④ C.①③④ D.②③④ 組卷:22引用:3難度:0.9 -
2.固體碘在受熱時發(fā)生升華現(xiàn)象,有關(guān)敘述正確的是( )
A.碘受熱升華,破壞的是分子間作用力,未破壞I-I共價鍵,因此未發(fā)生吸熱反應(yīng) B.碘受熱升華,吸收熱量,發(fā)生了吸熱反應(yīng) C.碘升華,未破壞共價鍵,不供應(yīng)熱量也能發(fā)生 D.碘升華過程中,熱能轉(zhuǎn)變?yōu)榛瘜W能 組卷:49引用:2難度:0.9 -
3.下列與化學反應(yīng)能量變化相關(guān)的敘述正確的是( )
A.生成物總能量一定低于反應(yīng)物總能量 B.放熱反應(yīng)的反應(yīng)速率總是大于吸熱反應(yīng)的反應(yīng)速率 C.應(yīng)用蓋斯定律,可計算某些難以直接測量的反應(yīng)焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 組卷:1193引用:169難度:0.9 -
4.下列變化為放熱的化學反應(yīng)的是( )
A.H2O(g)═H2O(l)△H=-44.0 kJ/mol B.2HI(g)═H2(g)+I2(g)△H=+14.9 kJ/mol C.形成化學鍵時共放出862 kJ能量的化學反應(yīng) D. 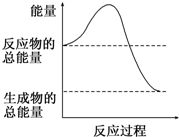
能量變化如圖所示的化學反應(yīng)組卷:57引用:18難度:0.7 -
5.一些烷烴的燃燒熱(kJ/mol)如下表:
下列表達正確的是( )化合物 燃燒熱 化合物 燃燒熱 甲烷 891.0 正丁烷 2878.0 乙烷 1560.8 異丁烷 2869.6 丙烷 2221.5 2甲基丁烷 3531.3 A.熱穩(wěn)定性:正丁烷>異丁烷 B.乙烷燃燒的熱化學方程式為:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ/mol C.正戊烷的燃燒熱大于3 531.3 kJ/mol D.相同質(zhì)量的烷烴,碳的質(zhì)量分數(shù)越大,燃燒放出的熱量越多 組卷:49引用:2難度:0.9
二、非選擇題(共30分)
-
15.依據(jù)事實,寫出下列反應(yīng)的熱化學方程式.
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃燒生成CO2和液態(tài)水時放熱22.68kJ.則表示甲醇燃燒熱的熱化學方程式為.
(2)若適量的N2和O2完全反應(yīng),每生成23克NO2需要吸收16.95kJ熱量:.
(3)用NA表示阿伏加德羅常數(shù),在C2H2(氣態(tài))完全燃燒生成CO2和液態(tài)水的反應(yīng)中,每有5NA個電子轉(zhuǎn)移時,放出650kJ的熱量:.組卷:28引用:9難度:0.5
三、計算題(共15分)
-
16.用CH4催化還原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1
若用標準狀況下4.48L CH4還原NO2至N2,整個過程中轉(zhuǎn)移的電子總數(shù)為,寫出上述反應(yīng)的熱化學方程式:.組卷:34引用:7難度:0.5


