2017-2018學年黑龍江省大慶鐵人中學高二(下)開學化學試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題:(本題共包括18個小題,每小題只有一個選項最符合題意,每小題3分,共54分.)
-
1.下列說法中不正確的是( )
A.分子組成相差一個或幾個CH2原子團的有機物不一定是同系物 B.乙烯、聚氯乙烯結構中都含有碳碳雙鍵 C.CH2Cl2只有一種結構說明甲烷分子是正四面體結構,而不是平面正方形結構 D.分子中僅含有碳、氫元素的化合物是烴 組卷:29引用:3難度:0.7 -
2.下列說法正確的是( )
A.難溶電解質作比較時,Ksp小的,溶解度一定小 B.Ksp大小取決于難溶電解質的溶解度,所以離子濃度改變時Ksp會發生變化 C.所謂沉淀完全就是用沉淀劑將溶液中某一離子完全除去 D.溫度一定,當溶液中Ag+和Cl-濃度的乘積等Ksp時,溶液為AgCl的飽和溶液 組卷:1引用:1難度:0.5 -
3.下列按純凈物、混合物、電解質和非電解質順序排列的是( )
A.鹽酸、空氣、醋酸、干冰 B.冰醋酸、水玻璃、硫酸鈉、乙醇 C.液氯、堿石灰、苛性鉀、石灰石 D.膽礬、漂白粉、氯化鉀、硫酸鋇 組卷:11引用:2難度:0.8 -
4.常溫下,某溶液中由水電離的c(H+)=1×10-13mol/L,該溶液可能是( )
①二氧化硫水溶液 ②氯化銨水溶液 ③碳酸鈉水溶液 ④氫氧化鈉水溶液A.①② B.②③ C.①④ D.③④ 組卷:3引用:1難度:0.8 -
5.濃度均為0.1mol/L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四種溶液,按pH值由小到大排列的順序是( )
A.①②③④ B.④③①② C.③④①② D.②①④③ 組卷:30引用:3難度:0.9 -
6.某學生的實驗報告所列出的下列數據中合理的是( )
A.用10mL量筒量取7.13mL稀鹽酸 B.用酸式滴定管量取13.17mL稀鹽酸 C.用廣泛pH試紙測得某溶液的pH為2.3 D.用天平稱取物品的質量為5.872g 組卷:21引用:3難度:0.9 -
7.10mL濃度為1mol/L的鹽酸與過量的鋅粉反應,若加入適量的下列溶液,能減慢反應速率但又不影響氫氣生成的是( )
A.H2SO4 B.CuSO4 C.CH3COONa D.Na2CO3 組卷:10引用:2難度:0.5
二、解答題(共4小題,滿分46分)
-
21.利用如圖所示裝置,甲中盛有100mL 0.1mol/L CuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
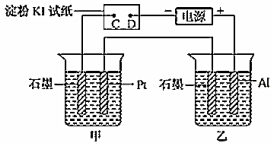
(1)通電一段時間,觀察到濕潤的淀粉KI試紙的(選填“C”或“D”)端變藍。
(2)裝置乙中Al極的電極反應式為:。一段時間后觀察到裝置乙中的現象是:。
(3)若電解一段時間后,裝置甲中收集到氣體0.056L(標準狀況下),則:裝置甲中發生反應的離子反應方程式為。
(4)若電解一段時間后,裝置甲中溶液需加入0.005molCu2(OH)2CO3才能恢復原來的濃度和pH,則電解過程中轉移電子的物質的量為。
(5)某新型燃料電池,以甲醇為燃料,另一極通入一定量的CO2和O2的混合氣體。一定比例的Li2CO3和Na2CO3的熔融混合物為電解質,則負極反應式為。正極反應式為。組卷:1引用:1難度:0.6 -
22.弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶解平衡均屬于化學平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-
(1)某溫度下,若向0.1mol?L-1的NaHA溶液中逐滴滴加0.1 mol?L-1 KOH溶液至溶液呈中性(忽略混合后溶液的體積變化)。此時該混合溶液中的下列關系一定正確的是。
A.c(H+)?c(OH-)=1.0×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol?L-1
(2)已知常溫下H2A的鈣鹽(CaA)的飽和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2+(aq)△H>0.若要使該溶液中Ca2+濃度變小,可采取的措施有。
A.升高溫度 B.降低溫度 C.加入NH4Cl晶體 D.加入Na2A固體
Ⅱ.含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.0×10-3mol?L-1的Cr2O72-.為了使廢水的排放達標,進行如下處理:
Cr2O72-Cr3+、Fe3+綠礬、H+(Ⅰ)Cr(OH)3、Fe(OH)3石灰水(Ⅱ)
(1)該廢水中加入綠礬和H+,發生反應的離子方程式為。
(2)若處理后的廢水中殘留的c(Fe3+)=2.0×10-13mol?L-1,則殘留的Cr3+的濃度為。(已知:Ksp[Fe(OH)3)]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)組卷:8引用:3難度:0.5


