2020-2021學年北京市東城區高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共20小題,每小題2.5分,滿分50.0分)
-
1.下列生活中常用的方法,其原理與鹽類的水解反應有關的是( )
A.用明礬凈水 B.用酒精進行環境消毒 C.用3%的H2O2溶液清洗傷口 D.用白醋清洗水壺中的水垢 組卷:40引用:5難度:0.8 -
2.常溫下,下列溶液中,c(H+)=10-2mol/L的是( )
A.0.2mol/L H2SO4 B.pH=12的NaOH溶液 C.pH=2的鹽酸 D.0.01mol/L氨水 組卷:110引用:4難度:0.8 -
3.下列有關原子光譜的說法中,不正確的是( )
A.通過光譜分析可以鑒定某些元素 B.電子由低能級躍遷至較高能級時,一定發生的是化學變化 C.燃放的焰火在夜空中呈現五彩繽紛的禮花與原子核外電子的躍遷有關 D.原子中的電子在躍遷時能量的表現形式之一是光,這也是原子光譜產生的原因 組卷:69引用:2難度:0.7 -
4.按照F、Cl、Br的順序,下列敘述正確的是( )
A.第一電離能依次減小 B.原子半徑依次減小 C.電負性依次增大 D.對應氫化物分子中的化學鍵鍵能依次增大 組卷:22引用:2難度:0.8 -
5.下列說法不正確的是( )
A.鋼鐵的吸氧腐蝕和析氫腐蝕的負極反應均為Fe-2e-═Fe2+ B.鋼鐵發生吸氧腐蝕,正極的電極反應為O2+2H2O+4e-═4OH- C.破損后的鍍鋅鐵板比鍍錫鐵板更耐腐蝕 D.用犧牲陽極的陰極保護法保護鋼鐵,鋼鐵作原電池的負極 組卷:214引用:3難度:0.4 -
6.下列事實能證明醋酸是弱電解質的是( )
A.醋酸鈉的水溶液中存在OH- B.常溫時,等濃度醋酸溶液的導電性比鹽酸弱 C.0.1mol/L醋酸溶液可使石蕊溶液變紅 D.醋酸溶液與碳酸鈉溶液反應可產生CO2 組卷:45引用:3難度:0.7 -
7.下列有關化學用語表述正確的是( )
A.基態氮原子核外電子排布的軌道表示式: 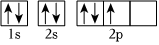
B.用原子軌道描述氫分子中化學鍵的形成: 
C.基態鈣原子的簡化電子排布式:[Ar]3d2 D.一水合氨的電離方程式:NH3?H2O? +OH-NH+4組卷:72引用:2難度:0.7 -
8.下列說法不正確的是( )
A.NH4NO3溶于水吸熱,說明其溶于水不是自發過程 B.水凝結成冰的過程中,體系的混亂度變化△S<0 C.某化學反應自發進行的方向,與反應的△H和△S都有關 D.發生離子反應的條件之一是生成氣體,此過程是一個△S>0的過程 組卷:146引用:8難度:0.7
二、解答題(共6小題,滿分50分)
-
25.某小組同學用下列試劑研究將AgCl轉化為AgI。(已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
(1)實驗操作
(試劑:0.1mol/L NaCl溶液,0.1mol/L AgNO3溶液,0.1mol/L KI溶液)向盛有2mL 0.1mol/L NaCl溶液的試管中(將操作補充完整)。
(2)實驗現象
上述實驗中的現象可證明AgCl轉化為AgI。
(3)實驗分析及討論
①該沉淀轉化反應的離子方程式是。
②定性分析。結合圖示或文字說明該轉化與AgCl和AgI的沉淀溶解平衡均有關:。
③定量分析。由上述沉淀轉化反應的化學平衡常數表達式可推導:K==c(Cl-)c(I-)=c(Cl-)?c(Ag+)c(I-)?c(Ag+)。(列式即可,不必計算結果)
④同學們結合③中的分析方法,認為教材中的表述:“一般來說,溶解度小的沉淀轉化為溶解度更小的沉淀容易實現”,可進一步表述為。組卷:62引用:1難度:0.7 -
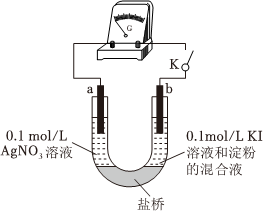 26.某同學設計如下實驗裝置實現AgNO3溶液和KI溶液間的反應(a、b均為石墨)。
26.某同學設計如下實驗裝置實現AgNO3溶液和KI溶液間的反應(a、b均為石墨)。
(1)當K閉合后,發現電流計指針偏轉,b極附近溶液變藍。
①b極發生的是(填“氧化”或“還原”)反應。
②a極上的電極反應式是。
(2)事實證明:AgNO3溶液與KI溶液混合只能得到AgI沉淀,對比(1)中反應,從反應原理的角度解釋產生該事實的可能原因:。組卷:42引用:1難度:0.6


