2022-2023學年北京市東直門中學高二(上)期中化學試卷
發布:2024/9/20 1:0:9
一、選擇題(共54分)
-
1.中華民族的發明創造為人類文明進步做出了巨大貢獻,下列過程主要是利用化學反應中能量變化的是( )
A B C D 
神十一載人飛船發射
糧食釀醋
濕法煉銅
打磨磁石制司南A.A B.B C.C D.D 組卷:4引用:6難度:0.8 -
2.下列做法的目的與改變化學反應速率無關的是( )
A.在糕點包裝內放置小包除氧劑 B.在糖果制作過程中添加著色劑 C.高爐煉鐵前先將鐵礦石粉碎 D.牛奶在冰箱里保存 組卷:37引用:5難度:0.5 -
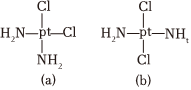 3.科學研究發現鉑的兩種化合物(短線表示化學鍵)有不同的特性,其中a具有抗癌作用,而b沒有;則下列正確的說法是( )
3.科學研究發現鉑的兩種化合物(短線表示化學鍵)有不同的特性,其中a具有抗癌作用,而b沒有;則下列正確的說法是( )A.a、b分子中,Pt原子與2個Cl原子,2個N原子間形成的結構與CH2Cl2相似 B.a在水中的溶解度比b在水中的溶解度大 C.a、b互為同素異形體 D.a、b是同一物質 組卷:29引用:4難度:0.5 -
4.可逆反應2HI(g)?H2(g)+I2(g)在體積固定的密閉容器中,下列說法不能說明反應達到化學平衡狀態的是( )
A.混合氣體的壓強不再改變 B.混合氣體的顏色不再改變 C.H2的體積分數不再變化 D.HI的轉化率不再改變 組卷:37引用:4難度:0.7 -
5.一定量的鐵粉和水蒸氣在一個容積可變的密閉容器中進行反應:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)。下列條件能使該反應的化學反應速率增大的是( )高溫A.增加鐵粉的質量 B.保持體積不變,充入N2,使體系壓強增大 C.將容器的體積縮小一半 D.保持壓強不變,充入N2,使容器的體積增大 組卷:141引用:7難度:0.5 -
6.工業上處理含CO、SO2煙道氣的一種方法是將其在催化劑作用下轉化為S和CO2。
已知:2CO(g)+O2(g)═2CO2(g)ΔH=-566kJ/mol
S(s)+O2(g)═SO2(g)ΔH=-296kJ/mol
則該條件下2CO(g)+SO2(g)═S(s)+2CO2(g)的ΔH等于( )A.-270kJ/mol B.+26kJ/mol C.-582kJ/mol D.+270kJ/mol 組卷:279引用:16難度:0.8 -
7.2mol NH3和3mol O2在2L密閉容器中發生反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g),2min后達到平衡,生成1.5mol NO.下列有關說法正確的是( )
A.達到平衡時,4υ正(O2)=5υ逆(NO) B.若單位時間內生成x mol NO,同時消耗x mol NH3,則反應達到平衡狀態 C.達到平衡時,若增加容器體積,則υ正減少,υ逆增大 D.2min內用NH3表示的反應速率為υ(NH3)=0.75mol?L-1?min-1 組卷:28引用:7難度:0.7 -
8.已知:①2H2(g)+O2(g)═2H2O(g) ΔH=-483.6kJ?mol-1
②H2(g)+S(g)═H2S(g) ΔH=-20.1kJ?mol-1
下列判斷正確的是( )A.1mol氫氣完全燃燒生成液態水吸收熱量241.8kJ B.1molH2O(g)和1molH2S(g)的能量相差221.7kJ C.由①②知,水的熱穩定性強于硫化氫 D.若反應②中改用固態硫,則1molS(s)完全反應放出的熱量小于20.1kJ 組卷:5引用:2難度:0.5 -
9.汽車尾氣處理時存在反應:NO2(g)+CO(g)?NO(g)+CO2(g),該反應過程及能量變化如圖所示。下列說法正確的是( )

A.使用催化劑活化分子百分數不變 B.使用催化劑,反應物分子的能量變高 C.使用催化劑可以有效減少反應放出的熱量 D.無論是反應物還是生成物,轉化為活化絡合物都要吸收能量 組卷:17引用:2難度:0.5
二、非選擇題(共46分)
-
27.實驗小組探究酸對Fe3++3SCN-?Fe(SCN)3平衡的影響。將0.005mol?L-1FeCl3溶液(接近無色)和0.01mol?L-1KSCN溶液等體積混合,得到紅色溶液。
已知:FeCl3溶液呈酸性的原因是Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+。
(1)甲同學認加入酸后,會使Fe3++3SCN?Fe(SCN)3體系中增大,導致該平衡正向移動,溶液顏色加深。
【設計并實施實驗】
取兩等份紅色溶液,進行如下操作并記錄現象。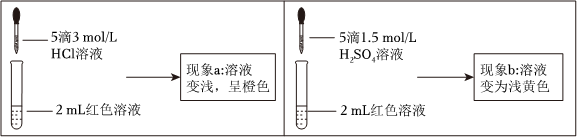
[查閱資料]
Fe3+和Cl-、均能發生絡合反應(配位平衡):SO2-4
Fe3++4Cl-?[FeCl4]-(黃色);
Fe3++2?[Fe(SO4)2]-(無色)。SO2-4
實驗Ⅰ.探究現象a中溶液顏色變化的原因
(2)實驗①的目的是編號 操作 現象 ① 向2mL紅色溶液中滴加5滴水 溶液顏色無明顯變化 ② 向2mL紅色溶液中滴加5滴3mol?L-1KCl溶液 溶液顏色變淺,呈橙色 。
(3)根據實驗①和實驗②的結果,從平衡移動角度解釋現象a。
實驗Ⅱ.探究現象b中溶液呈淺黃色的原因
(4)結合實驗③可推測現象b中使溶液呈淺黃色的微粒可能有兩種,分別是編號 操作 現象 ③ 取1mL0.0025mol?L-1Fe2(SO4)3溶液(無色)。加入1mL0.01mol?L-1KSCN溶液,再加入5滴1.5mol?L-1H2SO4溶液 溶液先變紅,加硫酸后變為淺黃色 ④ 取1mL0.005mol?L-1FeCl3溶液, 。
(5)乙同學進一步補充了實驗④,確證了現象b中使溶液呈淺黃色的微粒只是(4)中的一種,請將實驗④的操作及現象補充完整:、。組卷:25引用:2難度:0.6 -
28.氨在國民經濟中占有重要地位。
(1)合成氨工業中,合成塔中每產生2molNH3,放出92.2kJ熱量。
①工業合成氨的熱化學方程式是。
②若起始時向容器內放入2molN2和6molH2,達平衡時放出的熱量為Q,則Q(填“>”“<”或“=”)184.4kJ。
③已知(圖1),1molN-H鍵斷裂吸收的能量等于kJ。
④理論上,為了增大平衡時H2的轉化率,可采取的措施是(填序號)。
a.增大壓強
b.使用合適的催化劑
c.升高溫度
d.及時分離出產物中的NH3
(2)原料氣H2可通過反應CH4(g)+H2O(g)?CO(g)+3H2(g)獲取,已知該反應中,當初始混合氣中的恒定時,溫度、壓強對平衡混合氣中CH4含量的影響如圖2所示。圖中兩條曲線表示的壓強的關系是:p1n(H2O)n(CH4)p2(填“>”“=”或“<”)。
(3)原料氣H2還可通過反應CO(g)+H2O(g)?CO2(g)+H2(g)獲取。
①T℃時,向容積固定為5L的容器中充入1mol水蒸氣和1molCO,反應達平衡后,測得CO的濃度為0.08mol?L-1,則該溫度下反應的平衡常數K為。
②保持溫度仍為T℃,改變水蒸氣和CO的初始物質的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態的是(填序號)。
a.混合氣體的平均相對分子質量不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內生成amolCO2的同時消耗amolH2
d.混合氣中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(4)工業上以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(1),該反應的平衡常數和溫度關系如表:
①焓變△H(填“>”“<”或“=”)T/℃ 165 175 185 195 K 111.9 74.1 50.6 34.8 0。
②在一定溫度和壓強下,若原料氣中的NH3和CO2的物質的量之比(氨碳比)=x,圖3是氨碳比(x)與CO2平衡轉化率(α%)的關系。圖中的B點處,NH3的平衡轉化率為n(NH3)n(CO2)。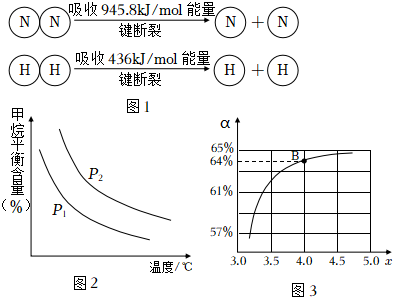 組卷:20引用:2難度:0.5
組卷:20引用:2難度:0.5


