2023-2024學年云南師大附中高一(上)期中化學試卷
發布:2024/10/3 4:0:1
一、選擇題(本大題共20小題,每小題2.5分,共50分。在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.下列現象中,不涉及氧化還原反應的是( )
A.金屬的冶煉 B.食物的腐敗 C.鐵軌的腐蝕 D.鐘乳石的形成 組卷:5引用:1難度:0.5 -
2.某飲料的配料表如圖所示,下列說法不正確的是( )
配料:
水、蔗糖、氧化鈉、濃縮果汁、檸檬酸鈉、山梨酸鉀、蘋果酸、維生素C……A.蘋果酸可以與氫氧化鈉反應 B.維生素C可作抗氧化劑是由于其易被氧化 C.濃縮果汁是純凈物 D.山梨酸鉀是電解質 組卷:7引用:2難度:0.7 -
3.分類思想在科學研究中發揮著重要的作用,下列說法正確的是( )
A.金屬氧化物一定是堿性氧化物 B.Mg2(OH)2CO3既屬于碳酸鹽,又屬于鎂鹽 C.NaHCO3在水中的電離方程式為NaHCO3=Na++H++ CO2-3D.根據是否有丁達爾效應,把混合物分為溶液、膠體、濁液 組卷:12引用:2難度:0.5 -
4.下列關于物質之間轉化的說法正確的是( )
A.KClO3轉化為KCl,需要加入還原劑才能實現 B.Fe轉化為Fe(OH)3的路線:Fe FeCl3氯氣Fe(OH)3NaOHC.Cu轉化為Cu(OH)2的路線:Cu CuO氧氣Cu(OH)2水D.BaCl2溶液轉化為BaCO3沉淀:BaCl2(aq) BaCO3CO2組卷:46引用:2難度:0.8 -
5.下列實驗方案能達到目的的是( )
選項 實驗目的 實驗方案 A 驗證溶液中含有 CO2-3取樣于試管中,滴加鹽酸,產生能使澄清石灰水變渾濁的無色無味氣體 B 制備氫氧化鐵膠體 把飽和FeCl3溶液滴入氨水中并加熱 C 檢驗Cl2是否已收集滿 用濕潤的藍色石蕊試紙靠近瓶口 D 檢測新制氯水的pH 用玻璃棒蘸取少量樣品滴到干燥pH試紙上,待顯色完全后與標準比色卡對比 A.A B.B C.C D.D 組卷:10引用:4難度:0.6 -
6.電導率是衡量物質導電能力大小的物理量。將NaOH稀溶液滴加到稀鹽酸過程中電導率曲線如圖所示。下列說法不正確的是( )
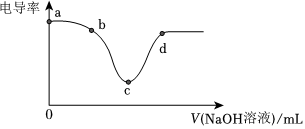
A.b點反應的離子方程式為H++OH-=H2O B.把NaOH稀溶液換成NaOH固體,電導率曲線不變 C.溶液的酸性:a>b>c>d D.c點溶液呈中性 組卷:19引用:3難度:0.8 -
7.下列離子方程式書寫正確的是( )
A.少量H2SO4滴入Ba(OH)2中:H++ +Ba2++OH-=BaSO4↓+H2OSO2-4B.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- C.Ba(OH)2溶液中滴加Fe2(SO4)3:Ba2++ =BaSO4↓SO2-4D.過量CO2通入澄清石灰水中:OH-+CO2= HCO-3組卷:16引用:2難度:0.8 -
8.下列各組離子一定能大量共存的是( )
A.堿性溶液中: 、Cl-、Na+、HSO-3NO-3B.酸性無色透明溶液中:Fe3+、Cl-、K+、 SO2-4C.使石蕊變紅的溶液中:K+、 、I-、Na+NO-3D.中性溶液中:Ca2+、Cl-、I-、Na+ 組卷:26引用:2難度:0.8
二、填空題(本大題共4小題,共50分)
-
23.NaCl是一種重要的化工原料,可以從海水中提取,并用于制備多種物質,流程圖如圖所示:

回答下列問題:
(1)過程①主要是粗鹽的提純,加入藥品及操作順序不正確的是(填序號)。
A.NaOH→BaCl2→Na2CO3→過濾→HCl
B.BaCl2→Na2CO3→NaOH→過濾→HCl
C.NaOH→Na2CO3→BaCl2→過濾→HCl
D.BaCl2→NaOH→Na2CO3→HCl→過濾
(2)過程②中NaCl溶液通電后,發生反應的離子方程式為。每轉移2.5NA個電子,可制得NaOHg。
(3)過程④⑤中可循環利用的物質是。
(4)過程⑤反應的化學方程式為。組卷:16引用:2難度:0.7 -
24.NaClO是一種常用的消毒劑和漂白劑,某實驗小組設計如下實驗制備NaClO溶液、測定其含量,并探究其漂白棉布效果。制備NaClO的裝置如圖所示,請回答下列問題:
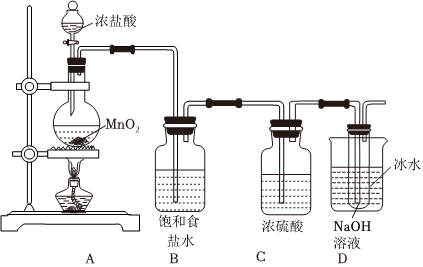
(1)盛裝濃鹽酸的儀器名稱為,裝置B的作用是。
(2)寫出裝置A中反應的化學方程式并用雙線橋標出電子轉移情況:。裝置D中反應的離子方程式為。
(3)有同學提出四點意見:①裝置A不需要加熱;②裝置C沒有必要;③裝置D后再連一個裝置裝堿石灰做尾氣處理;④把裝置D中冰水換成沸騰的熱水以加快反應速率。合理的是。
(4)漂白液中NaClO含量測定:取50mL制得的漂白液樣品于錐形瓶中,加過量KI溶液,發生反應生成NaCl和I2;再用Na2S2O3去測定I2的量,原理為I2+2S2=2I-+S4O2-3,消耗Na2S2O30.08mol,則漂白液中NaClO的含量為O2-6g/L。
(5)已知:①棉布被次氯酸鈉漂白時都會受到一定的損傷;②織物斷裂強度是指織物在被拉斷時所能承受的最大荷重,單位為kg;③強酸性環境下漂白液中會逸出黃綠色氣體。探究次氯酸鈉漂白棉布的pH后,得出不同pH與漂白速率的關系、不同pH與被漂白棉布斷裂強度的關系分別如圖所示:
由圖可知,pH越小漂白速率越(填“快”“慢”或“無影響”),實際漂白時pH的最佳范圍是9~11,不宜選擇酸性、中性的原因是。組卷:4引用:2難度:0.7


