2022年江蘇省蘇錫常鎮四市高考化學一模試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.南梁陶弘景在《本草經集注》中記載了石灰的制法與性質:“近山生石,青白色;作灶燒竟,以水沃之,即熱蒸而解。”下列有關說法不正確的是( )
A.“青白色石”主要成分是CaCO3 B.“作灶燒竟”過程發生分解反應 C.“以水沃之”過程放出大量的熱 D.“熱蒸而解”表明石灰受熱溶解 組卷:16引用:3難度:0.6 -
2.反應2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O可用于制備含氯消毒劑。下列說法正確的是( )
A.ClO3-的空間構型為三角錐型 B.HCl和NaCl所含化學鍵類型相同 C.ClO2是非極性分子 D.中子數為20的氯原子可表示為 Cl2017組卷:42引用:3難度:0.7 -
3.下列有關酸的性質與用途具有對應關系的是( )
A.鹽酸具有還原性,可用于金屬除銹 B.濃硫酸具有脫水性,可用作干燥劑 C.過氧乙酸有強氧化性,可用作消毒劑 D.硝酸具有揮發性,可用于制造化肥 組卷:24引用:5難度:0.6 -
4.汽車尾氣中的CO、NOx、硫氧化物、乙烯、丙烯等碳氫化合物會引起光化學煙霧、酸雨等污染;汽油抗震添加劑四乙基鉛(熔點-136℃,極易揮發)的排放嚴重危害人體中樞神經系統。汽車尾氣凈化裝置可將污染物中的CO和NO轉化為無害氣體,發生反應為2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-746.5kJ?mol-1。下列有關說法正確的是( )
A.SO2和SO3中的鍵角相等 B.丙烯能形成分子間氫鍵 C.N2中σ鍵和π鍵數目之比為1:2 D.固態四乙基鉛為離子晶體 組卷:80引用:3難度:0.6 -
5.汽車尾氣中的CO、NOx、硫氧化物、乙烯、丙烯等碳氫化合物會引起光化學煙霧、酸雨等污染;汽油抗震添加劑四乙基鉛(熔點-136℃,極易揮發)的排放嚴重危害人體中樞神經系統。汽車尾氣凈化裝置可將污染物中的CO和NO轉化為無害氣體,發生反應為2CO(g)+2NO(g)=N2(g)+2CO2(g)ΔH=-746.5kJ?mol-1。在指定條件下,下列有關汽車尾氣無害化處理或資源化利用的物質轉化能實現的是( )
A.CO(g) H2CO3(aq)H2O(1)B.CH2=CH2(g) 催化劑加熱加壓
C.NO(g) NaNO3(aq)NaOH(aq)D.SO2(g) CaSO4(S)CaO(g)組卷:116引用:1難度:0.5 -
6.汽車尾氣中的CO、NOx、硫氧化物、乙烯、丙烯等碳氫化合物會引起光化學煙霧、酸雨等污染;汽油抗震添加劑四乙基鉛(熔點-136℃,極易揮發)的排放嚴重危害人體中樞神經系統。汽車尾氣凈化裝置可將污染物中的CO和NO轉化為無害氣體,發生反應為2CO(g)+2NO(g)?N2(g)+2CO2(g)ΔH=-746.5kJ?mol-1。對于反應2CO(g)+2NO(g)?N2(g)+2CO2(g),下列說法正確的是( )
A.反應的平衡常數可表示為K= c(N2)?c(CO2)c(CO)?c(NO)B.使用催化劑可降低反應的活化能,減小反應的焓變 C.增大壓強能加快反應速率,提高反應物的平衡轉化率 D.用E總表示鍵能之和,該反應ΔH=E總(生成物)-E總(反應物) 組卷:107引用:4難度:0.5
二、非選擇題:共4題,共58分。
-
17.以酸性蝕刻液(主要含CuCl42-和H+)和堿性蝕刻液[主要含Cu(NH3)42+和Cl-]制備硫酸銅,并回收氯化銨的實驗流程如圖:
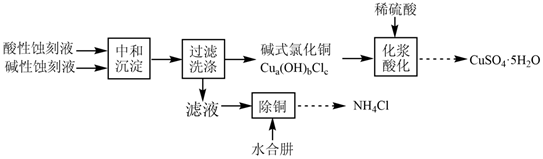
(1)將一定量酸性蝕刻液和堿性蝕刻液加入到三頸燒瓶(裝置如圖),通入NH3或HCl調節溶液pH在5.5左右,充分中和后,獲得堿式氯化銅沉淀。實驗中球形干燥管的作用是。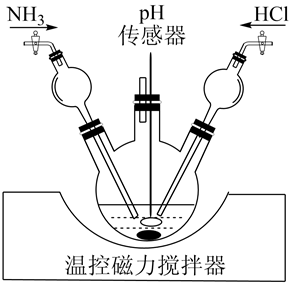
(2)為確定酸化時加入稀硫酸的用量,需測定堿式氯化銅的組成,請補充實驗方案:
I.取一定質量的堿式氯化銅固體,測定其中Cu元素的質量(具體步驟省略);
II.另取相同質量的堿式氯化銅固體,,低溫干燥至恒重。(可選用的試劑:2mol?L-1鹽酸、2mol?L-1硝酸、AgNO3溶液、蒸餾水)
(3)①化漿酸化后經結晶得硫酸銅粗品,其中含有的主要雜質是(填化學式)。
②將硫酸銅粗品溶于熱水形成飽和溶液,加入適量乙醇攪拌,冷卻后過濾,洗滌,可制得高純度CuSO4?5H2O。加入乙醇的目的是。
(4)向濾液中加入水合肼(N2H4?H2O)除去殘留的Cu2+,再經結晶獲得副產品氯化銨。除銅時,溶液pH控制在6~7為宜。若溶液pH大于8,Cu2+的去除率反而下降,其原因是。組卷:47引用:3難度:0.5 -
18.NO的治理是當前生態環境保護中的重要課題之一。
I.電化學技術
(1)利用固體氧化物電解池可將NO直接轉化為N2,實際應用中常將若干個電化學還原器結構單元組裝在一起,形成電堆,以提高NO的去除效率。
①紐扣式電化學還原器結構單元(其裝置如圖1所示)可疊加組裝成電堆使用。電解時,陰極發生的電極反應式為。
②長管式電化學還原器結構單元(其剖面結構如圖2所示)采用陰極微孔管作支撐,在管內外壁各設置一個對稱的陽極微孔管,陰陽極管壁之間填充有固體氧化物電解質,使用時常將該結構單元組裝成蜂窩狀電堆。當電堆體積一定時,相比于紐扣式反應器,長管式反應器的優點是。
II.NH3-SCR技術
(2)Cu基催化劑是NH3-SCR技術脫除NO中性能較為優異的新型催化劑,但煙氣中的SO2會造成Cu基催化劑的催化性能下降。加入CeO2(基態Ce原子核外電子排布式為[Xe]4f15d16s2)可抑制SO2對Cu基催化劑的影響,其作用機理如圖3所示(含Ce化合物的比例系數均未標定)。
①從整個反應機理來看,總反應中起還原作用的物質是(填化學式)。
②在上述反應機理圖中,CemOn的化學式為。
(3)將3%NO、6%NH3、21%O2和70%N2的混合氣體(N2為平衡氣)以一定流速通過裝有Cu基催化劑的反應器,NO去除率隨反應溫度的變化曲線如圖4所示。
①在150~225℃范圍內,NO去除率隨溫度的升高而迅速上升的原因是。
②燃煤煙氣中伴有一定濃度的HCl氣體,它會造成NO去除率下降,其原因可能是。組卷:50引用:2難度:0.5


