2021-2022學年江蘇省常州市教育學會高二(下)期末化學試卷
發布:2025/1/7 13:0:3
一、單項選擇題:共12小題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.我國最新研發的“液態陽光”計劃是利用太陽能電池板(主要材料為晶體Si)發電電解水制氫,再用H2與CO2合成CH3OH。下列說法不正確的是( )
A.晶體Si屬于分子晶體 B.電解水時電能轉化為化學能 C.CO2屬于非極性分子 D.合成CH3OH時H2作還原劑 組卷:15引用:2難度:0.7 -
2.實驗室利用反應NH4Cl+NaNO2
N2↑+NaCl+2H2O制備少量氮氣,下列說法正確的是( )△A.N的軌道表達式為 
B.Cl-的結構示意圖為 
C.NaNO2既含離子鍵又含共價鍵 D.N2的電子式為  組卷:7引用:1難度:0.7
組卷:7引用:1難度:0.7 -
3.下列實驗裝置能達到實驗目的的是( )
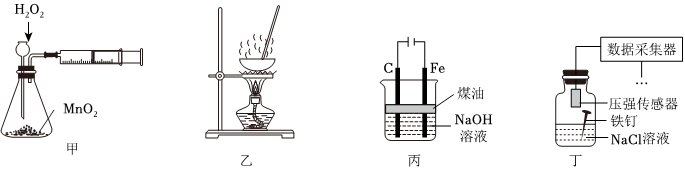
A.用裝置甲定量測定H2O2的分解速率 B.用裝置乙蒸干FeCl3溶液制備無水FeCl3固體 C.用裝置丙制備Fe(OH)2并能較長時間觀察其顏色 D.用裝置丁采集到的壓強數據判斷鐵釘發生吸氧腐蝕還是析氫腐蝕 組卷:10引用:3難度:0.7 -
4.下列有關物質的結構與性質的敘述不正確的是( )
A.K元素特殊的焰色反應是由于K原子核外電子能級躍遷吸收能量 B.乙烯易發生加成反應是由于分子中兩個碳原子間的π鍵容易斷裂 C.鍵能C-C>Si-Si、C-H>Si-H,因此C2H6穩定性大于Si2H6 D.金屬Na中的金屬鍵比金屬K中的金屬鍵強,因此金屬Na熔點高于K 組卷:41引用:2難度:0.6 -
5.化學反應原理在生產生活中有重要應用,下列說法不正確的是( )
A.鍋爐水垢中的CaSO4可先用Na2CO3溶液處理后,再用酸去除 B.在潮濕空氣中,表面破損的鍍錫鐵皮比鍍鋅鐵皮的腐蝕速率要快得多 C.電解精煉銅時,若陽極質量減少64g,則轉移到陰極的電子數為2mol D.銅片上鍍銀時,將銅片接在電源的負極上,用AgNO3溶液做電解質 組卷:41引用:3難度:0.5
二、非選擇題:共4題,共58分。
-
17.將CO2轉化為有機燃料是實現碳資源可持續利用的有效途徑。
(1)催化加氫制甲醇。向容積為2L的恒容、絕熱密閉容器中通入2.0molCO2和3.0molH2,發生反應如下:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.5kJ?mol-1催化劑
①反應在5min時達平衡,測得此時容器內CO2(g)與CH3OH(g)的物質的量之比為1:3,則前5min內,該反應的平均反應速率v(H2)=。
②下列可用來判斷該反應已達到平衡狀態的有(填標號)。
A.v正(CO2)=v逆(H2O)
B.容器中c(CH3OH)=c(H2O)
C.混合氣體的密度保持不變
D.容器內的溫度保持不變
③兩分子甲醇可進一步脫水制得二甲醚:2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.4kJ?mol-1,則2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) 的ΔH=。
(2)催化加氫制甲烷。向恒壓、密閉容器中通入1molCO2和4molH2,在催化劑作用下發生如下反應:
反應Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7kJ?mol-1
反應Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.2kJ?mol-1
反應Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g) ΔH=-247.1kJ?mol-1
上述反應達平衡時,容器中CO2、CH4和CO的物質的量隨溫度的變化關系如圖所示。
①曲線A表示的物質的量隨溫度的變化。
②800℃時曲線B代表物質的物質的量遠大于400℃時的物質的量,其原因是。
③曲線C代表物質的物質的量隨溫度的升高,先逐漸增大后逐漸減小。在200~600℃間,曲線C逐漸上升的原因是。組卷:41引用:2難度:0.6 -
18.H2S是形成PM2.5的重要前驅體,高效脫除H2S日趨成為重要的研究課題。
(1)生物技術在酸性溶液中,利用微生物T.F菌能夠實現天然氣中H2S的脫除,其原理如圖1所示。該脫除過程總反應的化學方程式為。
(2)化學技術利用高溫加熱法能夠在脫除H2S的同時,還獲得H2和S2,實現資源再生,其反應原理為H2S(g)?H2(g)+S2(g)。12
①常壓下,將H2S以一定流速通過反應管,分別在無催化劑、Al2O3作催化劑條件下,反應相同時間,實驗測得H2S的轉化率與溫度的關系如圖2所示。溫度高于1100℃后,無論是否使用催化劑Al2O3,H2S的轉化率都幾乎相等,其原因是。
②在Al2O3作催化劑條件下,保持反應器壓強、溫度不變,在H2S中按一定的比例摻入惰性氣體Ar,能提高熱分解反應時H2S的平衡轉化率,其原因是。
(3)光催化技術在紫外光照射下,TiO2光催化劑表面的活性位點能將空氣中的O2和H2O轉化成具有強氧化性的光生自由基,光生自由基再將已吸附在催化劑活性位點上的H2S快速氧化生成硫酸鹽,實現H2S的高效脫除。
①其他條件相同,向裝有8gTiO2光催化劑的反應艙內通入H2S。調整H2S的不同初始濃度,反應艙內H2S濃度隨時間變化關系如圖3所示。結合光催化技術原理分析,H2S初始濃度較小,其脫除速率較慢的原因是。
②其他條件相同,反應艙內H2S初始濃度為30mg/m3。調整反應艙內TiO2光催化劑的質量,H2S殘留率隨時間變化關系如圖4所示。隨著TiO2光催化劑的質量增加,H2S脫除速率逐漸提高,但提高的程度在逐漸減小,其原因可能是。組卷:17引用:1難度:0.6


