魯科版高二(下)高考題單元試卷:第1章 原子結構模型(01)
發布:2024/4/20 14:35:0
一、選擇題(共19小題)
-
1.短周期元素甲、乙、丙、丁的原子序數依次增大,甲和丁的原子核外均有兩個未成對電子,乙、丙、丁最高價氧化物對應的水化物兩兩之間能相互反應.下列說法錯誤的是( )
A.元素丙的單質可用于冶煉金屬 B.甲與丁形成的分子中有非極性分子 C.簡單離子半徑:丁>乙>丙 D.甲與乙形成的化合物均有氧化性 組卷:645引用:18難度:0.9 -
2.如表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,W元素原子的核電荷數為X元素的2倍。下列說法正確的是( )
X Y Z W T A.X、W、Z元素的原子半徑及它們的氣態氫化物的熱穩定性均依次遞增 B.Y、Z、W元素在自然界中均不能以游離態存在,它們的最高價氧化物的水化物的酸性依次遞增 C.YX2晶體熔化、液態WX3氣化均需克服分子間作用力 D.根據元素周期律,可以推測T元素的單質具有半導體特性,T2X3具有氧化性和還原性 組卷:3235引用:46難度:0.5 -
3.甲~庚等元素在周期表中的相對位置如圖,己的最高價氧化物對應水化物有強脫水性,甲和丁在同一周期,甲原子最外層與最內層具有相同電子數,下列判斷正確的是( )
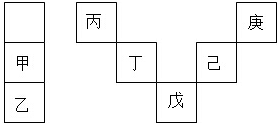
A.丙與戊的原子序數相差28 B.氣態氫化物的穩定性:庚<己<戊 C.常溫下,甲和乙的單質均能與水劇烈反應 D.丁的最高價氧化物可用于制造光導纖維 組卷:1954引用:23難度:0.7 -
4.下列四種元素中,其單質氧化性最強的是( )
A.原子含有未成對電子最多的第二周期元素 B.位于周期表中第三周期ⅢA族的元素 C.原子最外電子層排布為2s22p6的元素 D.原子最外電子層排布為3s23P5的元素 組卷:222引用:23難度:0.9 -
5.下列分子中所有原子都滿足最外層為8電子結構的是( )
A.SiCl4 B.H2O C.BF3 D.PCl5 組卷:94引用:87難度:0.9 -
6.下列有關物質性質的說法錯誤的是( )
A.熱穩定性:HCl>HI B.原子半徑:Na>Mg C.酸性:H2SO3>H2SO4 D.結合質子能力:S2->Cl- 組卷:1777引用:33難度:0.9 -
7.原子核外的M電子層和L電子層最多可容納的電子數( )
A.大于 B.小于 C.等于 D.不能肯定 組卷:123引用:12難度:0.9 -
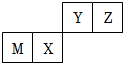 8.四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素。下列說法不正確的是( )
8.四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素。下列說法不正確的是( )A.原子半徑Z<M B.Y的最高價氧化物對應水化物的酸性比X的弱 C.X的最簡單氣態氫化物的熱穩定性比Z的小 D.Z位于元素周期表中第2周期第ⅥA族 組卷:526引用:76難度:0.9 -
9.X,Y,Z均為短周期元素,X,Y處于同一周期,X,Z的最低價離子分別為X2-和Z-,Y+和Z-具有相同的電子層結構。下列說法正確的是( )
A.原子最外層電子數:X>Y>Z B.單質沸點:X>Y>Z C.離子半徑:X2->Y+>Z- D.原子序數:X>Y>Z 組卷:1866引用:68難度:0.7 -
10.X、Y、Z為短周期元素,這些元素原子的最外層電子數分別是1、4、6.則由這三種元素組成的化合物的化學式不可能是( )
A.XYZ B.X2YZ C.X2YZ2 D.X2YZ3 組卷:272引用:16難度:0.7
三、解答題(共8小題)
-
29.元素單質及其化合物有廣泛用途,請根據周期表中第三周期元素相關知識回答下列問題:
(1)按原子序數遞增的順序(稀有氣體除外),下列說法正確的是
a.原子半徑和離子半徑均減小; b.金屬性減弱,非金屬性增強;
c.氧化物對應的水化物堿性減弱,酸性增強; d.單質的熔點降低.
(2)原子最外層電子數與次外層電子數相同的元素名稱為,氧化性最弱的簡單陽離子是
(3)已知:
工業制鎂時,電解MgCl2而不電解MgO的原因是化合物 MgO Al2O3 MgCl2 AlCl3 類型 離子化合物 離子化合物 離子化合物 共價化合物 熔點/℃ 2800 2050 714 191
制鋁時,電解Al2O3而不電解AlCl3的原因是
(4)晶體硅(熔點1410℃)是良好的半導體材料,由粗硅制純硅過程如下:
Si(粗)SiCl4Cl2460℃SiCl4(純)蒸餾Si(純)H21100℃
寫出SiCl4的電子式:.在上述由SiCl4制純硅的反應中,測得每生成1.12kg純硅需吸收a kJ熱量,寫出該反應的熱化學方程式:
(5)P2O5是非氧化性干燥劑,下列氣體不能用濃硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于實驗室制O2,若不加催化劑,400℃時分解只生成兩種鹽,其中一種是無氧酸鹽,另一種鹽的陰陽離子個數比為1:1,寫出該反應的化學方程式:.組卷:1859引用:29難度:0.5 -
30.鹵族元素包括F、Cl、Br等.
(1)下面曲線表示鹵族元素某種性質隨核電荷數的變化趨勢,正確的是.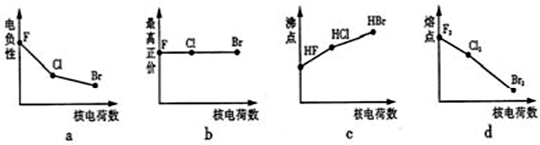
(2)利用“鹵化硼法”可合成含B和N兩種元素的功能陶瓷,如圖為其晶胞結構示意圖,則每個晶胞中含有B原子的個數為,該功能陶瓷的化學式為.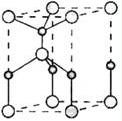
(3)BCl3和NCl3中心原子的雜化方式分別為和.第一電離能介于B、N之間的第二周期元素有種.
(4)若BCl3與XYn通過B原子與X原子間的配位鍵結合形成配合物,則該配合物中提供孤對電子的原子是.組卷:434引用:14難度:0.5


