2015-2016學年福建省廈門一中高二(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意,每小題2分,共40分)
-
1.下列有關化學用語表示正確的是( )
A.四氯化碳分子的比例模型 
B.次氯酸的結構式為H-Cl-O C.CO2的電子式是: 
D. O2-離子結構示意圖:188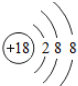 組卷:8引用:2難度:0.7
組卷:8引用:2難度:0.7 -
2.下列物質中,不能直接用單質反應制得的是( )
A.Cu2S B.SO2 C.FeCl2 D.NO 組卷:23引用:4難度:0.9 -
3.等量的鐵分別與足量的鹽酸、水蒸氣在一定的條件下充分反應,則在相同的條件下,產生氫氣的體積比是( )
A.1:1 B.3:4 C.2:3 D.4:3 組卷:372引用:26難度:0.9 -
4.下列物質中,含有共價鍵的離子化合物是( )
A.H2SO4 B.MgCl2 C.Na2O D.NaOH 組卷:33引用:10難度:0.9 -
5.下列過程屬于物理變化的是( )
①石油的分餾 ②煤的干餾 ③煤的氣化 ④蛋白質的變性 ⑤石油的催化裂化 ⑥蛋白質的鹽析⑦皂化反應.A.①③⑦ B.①⑥ C.②③④ D.①③⑤ 組卷:41引用:5難度:0.9 -
6.下列實驗中均需要的儀器是( )
①配制一定物質的量濃度的溶液 ②使用pH試紙測溶液的pH值 ③過濾 ④蒸發。A.試管 B.膠頭滴管 C.玻璃棒 D.漏斗 組卷:54引用:17難度:0.9 -
7.下列4種有色溶液:①品紅溶液②酸性高錳酸鉀溶液③溴水④滴有酚酞的NaOH溶液.它們與SO2作用均能褪色,其實質相同的是( )
A.①④ B.①②③ C.②③④ D.②③ 組卷:9引用:1難度:0.7 -
8.下列各項比較中錯誤的是( )
A.原子半徑:Li<Na<K B.酸性:H2SiO3<H2CO3<HNO3<HClO4 C.穩定性:SiH4>H2S>HF D.堿性:NaOH>Mg(OH)2>Be(OH)2 組卷:12引用:8難度:0.7
二、解答題(共5小題,滿分60分)
-
 24.A、B、C、D、E、F六種物質的轉化關系如圖所示(反應條件和部分產物未標出)
24.A、B、C、D、E、F六種物質的轉化關系如圖所示(反應條件和部分產物未標出)
(1)若A為常見的金屬單質,D、F是氣體且F的顏色為黃綠色,反應①在水溶液中進行.則①B為(填化學式).
②寫出能夠證明氧化性F>E的離子反應方程式為.
(2)若A為短周期金屬單質,D為短周期非金屬單質,且所含的原子序數A是D的2倍,F的濃溶液與A、D反應都有紅棕色氣體G產生,則:
①A、B分別為:A、B.
②若將一充滿XmLG和氧氣混合氣體的大試管倒立于水中,充分反應后,在相同條件下測得試管中余下YmL氣體,則原混合氣體中G和氧氣的體積可能為:G,氧氣.組卷:0引用:1難度:0.5 -
25.為探究鐵質材料與熱濃硝酸的反應,某學習小組用碳素鋼(即鐵和碳的合金)進行了以下探究活動:
【探究一】
(1)常溫下,工業上可用鐵質容器盛放冷的濃硫酸,其原因是
(2)稱取碳素鋼6.0g放入15.0mL濃硫酸中,加熱,充分反應后得到溶液X并收集到混合氣體Y.
①甲同學認為X中除Fe3+之外還可能含有Fe2+.產生Fe2+的離子反應方程式為:,檢驗是否有Fe2+應選用下列(選填序號)試劑.
A.KSCN溶液和氯水 B.鐵粉和KSCN溶液 C.濃氨水 D.酸性KMnO4溶液
②乙同學取560mL(標準狀況)氣體Y通入足量溴水中,可以發生:SO2+Br2+2H2O═2HBr+H2SO4反應,然后加入足量BaCl2溶液,經正確操作后得干燥固體4.66g.由此推知氣體Y中SO2的體積分數為.
【探究二】
根據上述實驗中SO2體積分數的分析,丙同學認為氣體Y中還可能含有Q1和Q2兩種氣體,其中Q1是相對分子質量最小的氣體,在標準狀況下,密度為0.0893g?L-1,Q2是空氣的成分之一,為此設計可下列探究實驗裝置(圖中夾持儀器省略,假設有關氣體完全反應).
(3)裝置B中試劑的作用是;
(4)用化學方程式表示Y氣體中的Q2氣體是如何生成的:
(5)為確認Q2的存在,需在裝置中添加洗氣瓶M于(選填序號)
a.A之前 b.A-B間 c.B-C間 d.C-D間.組卷:5引用:2難度:0.3


