2018-2019學年北京十五中高三(上)期中化學試卷
發布:2024/11/13 5:30:2
一.選擇題(42分,每小題只有一個正確答案,1-6題每小題2分,7-16題每小題2分)
-
1.中華民族的發明創造為人類文明進步做出了巨大貢獻,下列沒有涉及化學反應的是( )
A B C D 
神十一載人飛船發射
陶器燒制
濕法煉銅
打磨磁石制司南A.A B.B C.C D.D 組卷:11引用:5難度:0.9 -
2.在給定條件下,下列物質的轉化能實現的是( )
A.S SO3O2/點燃H2SO4H2OB.Na Na2OO2/點燃Na2CO3CO2C.NH3 NO2O2/催化劑HNO3H2OD.AI2O3 AlCl3(ap)HCl(ap)Al(OH)3過量氨水組卷:57引用:2難度:0.7 -
3.在一定條件下發生下列反應,其中反應后固體質量增加的是( )
A.氨氣還原氧化銅 B.二氧化錳加入過氧化氫溶液中 C.次氯酸鈣露置在空氣中變質 D.過氧化鈉吸收二氧化碳 組卷:22引用:2難度:0.7 -
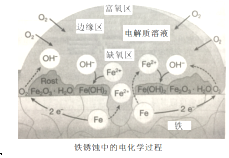 4.全世界每年因生銹損失的鋼鐵,約占世界年產量的十分之一。一種鋼鐵銹蝕原理示意圖如如,下列說法不正確的是( )
4.全世界每年因生銹損失的鋼鐵,約占世界年產量的十分之一。一種鋼鐵銹蝕原理示意圖如如,下列說法不正確的是( )A.缺氧區:Fe-2e-═Fe2+ B.富氧區:O2+2H2O+4e-═4OH- C.Fe失去的電子通過電解質溶液傳遞給O2 D.隔絕氧氣或電解質溶液均可有效防止鐵生銹 組卷:77引用:6難度:0.7 -
5.根據元素周期律,由下列事實進行歸納推測,推測不合理的是( )
選項 事實 推測 A Mg與冷水較難反應,Ca與冷水較易反應 Be(鈹)與冷水更難反應 B Na與Cl形成離子鍵,Al與Cl形成共價鍵 Si與Cl形成共價鍵 C HCl在1500℃時分解,HI在230℃時分解 HBr的分解溫度介于二者之間 D Si是半導體材料,同族的Ge是半導體材料 ⅣA族元素的單質都是半導體材料 A.A B.B C.C D.D 組卷:101引用:6難度:0.6 -
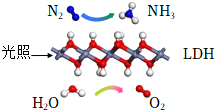 6.中國科學院科研團隊研究表明,在常溫常壓和可見光下,基于LDH(一種固體催化劑)合成NH3的原理示意圖如圖。下列說法不正確的是
6.中國科學院科研團隊研究表明,在常溫常壓和可見光下,基于LDH(一種固體催化劑)合成NH3的原理示意圖如圖。下列說法不正確的是
( )A.該過程將太陽能轉化為化學能 B.該過程中,只涉及極性鍵的斷裂與生成 C.氧化劑與還原劑的物質的量之比為1:3 D.原料氣N2可通過分離液態空氣獲得 組卷:130引用:12難度:0.8 -
7.下列解釋事實的離子方程式不正確的是( )
A.鋁片放入NaOH溶液中有氣體產生:2Al+2OH-+2H2O═2AlO2-+3H2↑ B.向K2Cr2O7溶液中滴加少量濃H2SO4,溶液橙色加深:Cr2O72-(橙色)+H2O?2CrO42-(黃色)+2H+ C.向Na2SiO3溶液中通入過量CO2制備硅酸凝膠:SiO32-+CO2+H2O═H2SiO3(膠體)+CO32- D.用Na2CO3溶液浸泡鍋爐水垢(含CaSO4):CaSO4+CO32-?CaCO3+SO42- 組卷:462引用:7難度:0.9
二.非選擇題(58分)
-
20.研究CO2在海洋中的轉移和歸宿,是當今海洋科學研究的前沿領域。
(1)溶于海水的CO2主要以4種無機碳形式存在,其中HCO占95%.寫出CO2溶于水產生HCO-3的方程式:-3。
(2)在海洋碳循環中,通過如圖所示的途徑固碳。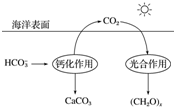
①寫出鈣化作用的離子方程式:。
②同位素示蹤法證實光合作用釋放出的O2只來自于H2O.用18O標記物質的光合作用的化學方程式如下,將其補充完整:+(CH2O)x+x18O2+xH2O光能葉綠體
(3)海水中溶解無機碳占海水總碳的95%以上,其準確測量是研究海洋碳循環的基礎。測量溶解無機碳,可采用如下方法:
①氣提、吸收CO2.用N2從酸化后的海水中吹出CO2并用堿液吸收(裝置示意圖如圖)。將虛線框中的裝置補充完整并標出所用試劑。
②滴定。將吸收液吸收的無機碳轉化為NaHCO3,再用x mol?L-1 HCl溶液滴定,消耗y mL HCl溶液。海水中溶解無機碳的濃度=mol?L-1。
(4)利用如圖所示裝置從海水中提取CO2,有利于減少環境溫室氣體含量。
①結合方程式簡述提取CO2的原理:。
②用該裝置產生的物質處理b室排出的海水,合格后排回大海。處理至合格的方法是。組卷:273引用:3難度:0.1 -
 21.納米Fe3O4在磁流體、催化劑、醫學等領域具有廣闊的應用前景。氧化共沉淀制備納米Fe3O4的方法如下:
21.納米Fe3O4在磁流體、催化劑、醫學等領域具有廣闊的應用前景。氧化共沉淀制備納米Fe3O4的方法如下:
1,Fe2+的氧化:將FeSO4溶液用NaOH溶液調節pH至a,再加入H2O2溶液,立即得到 FeO( OH)紅棕色懸濁液。
(1)①若用NaOH溶液調節pH過高會產生灰白色沉淀,該反應的離子方程式是
②上述反應完成后,測得a值與FeO(OH)產率及其生成后溶液pH的關系,結果如下:
用離子方程式解釋FeO( OH)生成后溶液pH下降的原因:a 7.0 8.0 9.0 FeO(OH)的產率 <50% 95% >95% FeO(OH)生成后pH 接近4 接近4 接近4 。
(2)經檢驗:當a=7時,產物中存在大量Fe2O3.對Fe2O3的產生提出兩種假設:
i.反應過程中溶液酸性增強,導致FeO( OH)向Fe2O3的轉化;
ii.溶液中存在少量Fe2+,導致FeO( OH)向Fe2O3的轉化。
①分析,假設i不成立的實驗依據是。
②其他條件相同時,向FeO( OH)濁液中加入不同濃度Fe2+,30min后測定物質的組成,結果如表:
以上結果表明:c(Fe2+)/mol?L-1 FeO(OH)百分含量/% Fe2O3百分含量/% 0.00 100 0 0.01 40 60 0.02 0 100 。
(3)a=7和a=9時,FeO( OH)產率差異很大的原因是。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO( OH)紅棕色懸濁液中同時加入FeSO4溶液和NaOH濃溶液進行共沉淀,再將此混合液加熱回流、冷卻、過濾、洗滌、干燥,得到納米Fe3O4。
(4)共沉淀時的反應條件對產物純度和產率的影響極大。
①共沉淀pH過高時,會導致FeSO4溶液被快速氧化;共沉淀pH過低時,得到的納米Fe3O4中會混有的物質是。
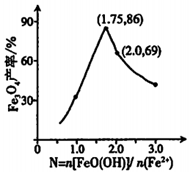
②已知N=n[FeO(OH)]/n(Fe2+),其他條件一定時,測得納米Fe3O4的產率隨N的變化曲線如圖所示:
經理論分析,N=2共沉淀時納米Fe3O4產率應最高,事實并非如此的可能原因是。組卷:51引用:5難度:0.5


