2021-2022學(xué)年廣東省珠海市高二(上)期末化學(xué)試卷
發(fā)布:2024/12/17 15:30:2
一、選擇題(本題共16小題,1~10每小題2分,11~16每小題2分,共44分。每小題只有一個選項符合題意)
-
1.下列有關(guān)化學(xué)反應(yīng)能量變化的說法錯誤的是( )
A.對于反應(yīng)H2(g)+Cl2(g)═2HCl(g),在光照和點燃條件下的ΔH不相同 B.C(s,金剛石)═C(s,石墨)ΔH<0,說明石墨比金剛石穩(wěn)定 C.熱化學(xué)方程式的ΔH大小與化學(xué)計量數(shù)有關(guān) D.若反應(yīng)物的鍵能總和小于生成物的鍵能總和,則該反應(yīng)是放熱反應(yīng) 組卷:33引用:5難度:0.6 -
2.化學(xué)在生活中的應(yīng)用隨處可見,下列措施不是為了改變化學(xué)反應(yīng)速率的是( )
A.將食品存放在冰箱中 B.做饅頭時添加膨松劑 C.月餅包裝袋內(nèi)放置還原鐵粉小袋 D.冶煉鐵時將鐵礦石粉碎 組卷:63引用:5難度:0.7 -
3.25℃時,下列各組離子在指定溶液中一定能大量共存的是( )
A.pH=1 的無色溶液中:Na+、Cu2+、Cl-、NO3- B. =10-8的溶液中:K+、Na+、NO3-、ClO-c(H+)c(OH-)C.0.1mol?L-1的FeCl2溶液中:H+、Al3+、SO42-、ClO- D.由水電離出的c(OH-)=1×10-11mol?L-1的溶液中:Mg2+、NH4+、SO42-、HCO3- 組卷:45引用:5難度:0.7 -
4.常溫下,下列事實不能說明某一元酸HX是弱酸的是( )
A.0.1mol?L-1HX溶液的pH=4 B.0.1mol?L-1NaX溶液pH>7 C.0.1mol?L-1HX溶液比0.1mol?L-1硝酸導(dǎo)電能力弱 D.10mL0.1mol?L-1NaOH溶液與10mL0.1mol?L-1HX溶液恰好中和 組卷:57引用:4難度:0.6 -
5.對于反應(yīng)2SO2(g)+O2(g)?2SO3(g) ΔH<0,下列有關(guān)說法正確的是( )
A.升高溫度可以提高SO2的平衡轉(zhuǎn)化率 B.只要選擇最佳的反應(yīng)條件,SO2和O2就能全部轉(zhuǎn)化為SO3 C.加入催化劑可以降低反應(yīng)的活化能,增加活化分子百分數(shù) D.提高 的值可增大O2的轉(zhuǎn)化率n(O2)n(SO2)組卷:39引用:3難度:0.5 -
6.下列事實與鹽類水解有關(guān)的是( )
①NaHCO3水溶液呈堿性;
②NaHSO4水溶液呈酸性;
③長期使用銨態(tài)氮肥,會使土壤酸度增大;
④銨態(tài)氮肥不能與草木灰混合施用;
⑤加熱能使純堿溶液去污能力增強;
⑥配制FeCl3溶液,需用鹽酸溶解FeCl3固體。A.除⑥以外 B.除②以外 C.除②、⑥以外 D.以上全部 組卷:112引用:6難度:0.7 -
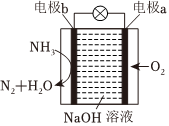 7.如圖所示為NH3-O2燃料電池裝置,下列說法錯誤的是( )
7.如圖所示為NH3-O2燃料電池裝置,下列說法錯誤的是( )A.電池工作時,O2得到電子,發(fā)生還原反應(yīng). B.電極b上的電極反應(yīng)式為2NH3+6OH--6e-═N2+6H2O C.燃料電池可以把化學(xué)能全部轉(zhuǎn)化為電能 D.電池工作時,溶液中的Na+向電極a遷移 組卷:176引用:5難度:0.6
二、非選擇題(共56分)
-
20.合成氨是人類科學(xué)技術(shù)上的一項重大突破:
(1)根據(jù)下表中鍵能寫出合成氨的熱化學(xué)方程式。
(2)科研小組模擬不同條件下的合成氨反應(yīng),向容器中充入amolN2和bmolH2,不同溫度下平衡混合物中氨氣的體積分數(shù)與總壓強(p)的關(guān)系如圖1:化學(xué)鍵 H-H O-H N≡N H-N E/(kJ?mol-1) 436 465 946 391 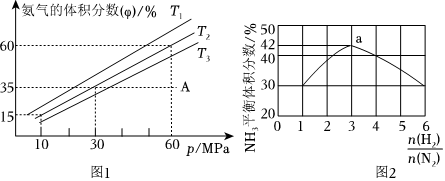
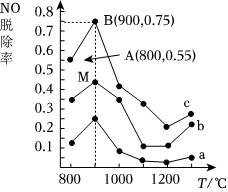
圖3
①T1、T2、T3由大到小的排序為。
②在T2、60MPa條件下,A點v正v逆(填“>”、“<”或“=”)
③圖2表示500℃、60.0 MPa條件下,合成氨反應(yīng)原料氣投料比與平衡時NH3體積分數(shù)的關(guān)系。根據(jù)圖中a點數(shù)據(jù)計算N2的平衡轉(zhuǎn)化率為%(結(jié)果保留一位小數(shù))。
(3)用NH3可消除NO污染,反應(yīng)原理為:4NH3+6NO?5N2+6H2O,以n(NH3):n(NO)分別為4:1、3:1、1:3 投料,得到NO脫除率隨溫度變化的曲線如圖3所示。
①曲線a對應(yīng)的n(NH3):n(NO)=。
②曲線c中NO的起始濃度為4×10-4mg/m3,從A點到B點(經(jīng)過0.8s,該時間段內(nèi)NO的脫除速率mg/(m3?s)。
③若體積為1L,n初(NO)=amol。求M點的平衡常數(shù)K=。(用計算式表示)組卷:11引用:2難度:0.6 -
21.某小組通過實驗驗證Ag++Fe2+?Fe3++Ag↓為可逆反應(yīng)并測定其平衡常數(shù)。
(1)實驗驗證Ag++Fe2+?Fe3++Ag↓為可逆反應(yīng)
實驗I:將0.0100mol?L-1Ag2SO4溶液與0.0400mol?L-1FeSO4溶液(pH=1)等體積混合,產(chǎn)生灰黑色沉淀。
實驗Ⅱ:向少量Ag粉中加入0.0100mol?L-1Fe2(SO4)3溶液(pH=1),固體完全溶解。
①取I中沉淀,加入濃硝酸,灰黑色固體溶解,產(chǎn)生紅棕色氣體,證實沉淀為。綜合.上述實驗,證實Ag++Fe2+?Fe3++Ag↓為可逆反應(yīng)。
②小組成員結(jié)合實驗結(jié)論提出FeCl3溶液也可以溶解Ag單質(zhì),你認為是否合理?(填“是”或“否”);并解釋原因:。
(2)測定平衡常數(shù)
實驗Ⅲ:一定溫度下,待實驗I中反應(yīng)達到平衡狀態(tài)時,取vmL上層清液,用clmol?L-1KSCN標準溶液滴定Ag+,至出現(xiàn)穩(wěn)定的淺紅色時,消耗KSCN標準溶液v1mL。
資料:Ag++SCN-?AgSCN(白色)K=1012
Fe3++SCN-?[FeSCN]2+(紅色)K=1023
①滴定過程中Fe3+的作用是。
②測得平衡常數(shù)K=。
(3)思考并回答問題:
①不用實驗Ⅱ中清液測定K的原因是。
②取實驗I的濁液測定c(Ag+),消耗KSCN標準溶液的體積(填“偏大”、“偏小”或“不受影響”。組卷:30引用:2難度:0.7


