2017-2018學年湖北省襄陽四中高三(上)第三周周考化學試卷(7月份)
發布:2024/4/20 14:35:0
一、選擇題
-
1.宋應星《天工開物》有關化學理論方面的記載。如“以硝石、硫磺為主,草木灰為輔。硝性至陰,硫性至陽,陰陽兩神物相遇于無隙可容之中。其出也,人物膺(承受)之,魂散驚而魄齏粉”。這句句話中涉及的化學反應原理是( )
A.復分解反應原理 B.氧化還原反應原理 C.水解原理 D.化學平衡原理 組卷:14引用:1難度:0.8 -
2.NA為阿伏加德羅常數的值.下列說法正確的是( )
A.19gNHD2和19gNH2T中含有的中子數均為10NA B.標準狀況下,22.4LO2參加反應轉移的電子數一定是4NA C.1molCnH2n中含有的共用電子對數為(3n+1)NA D.2molSO2和1molO2在一定條件下充分反應后,所得混合氣體的分子數大于2NA 組卷:4引用:3難度:0.9 -
3.下列實驗操作、現象和結論有錯誤的是( )
操作 現象 結論 A 向試管中的無色溶液內滴加稀NaOH溶液,將濕潤的紅色石蕊試紙置于試管口 試紙不變藍 不能確定原溶液中是否含有 NH+4B 加熱盛有銅與濃硫酸的試管,發現試管底部出現白色固體,直接向試管中加入適量水 白色固體溶解,溶液變藍色 白色固體為無水硫酸銅 C 將稀硫酸酸化的H2O2溶液滴入FeCl2溶液中 溶液變黃色 氧化性:H2O2>Fe3+ D 向蔗糖中加入濃硫酸,并不斷用玻璃棒攪拌 變黑,體積膨脹,放出刺激性氣體 濃硫酸具有脫水性和強氧化性,反應中生成C、SO2和CO2等 A.A B.B C.C D.D 組卷:17引用:2難度:0.7 -
4.我國某沿海地區綜合利用海洋資源的部分過程如圖所示,下列有關說法正確的是( )
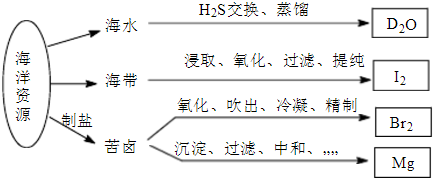
A.日曬鹽是重要的工業原料,氯堿工業中電解的是熔融NaCl B.從海帶中制得碘單質,氧化過程中選擇的氧化劑可以是Cl2或H2O2 C.從苦鹵中制得的Br2應該用鐵桶密封保存 D.苦鹵制Mg的過程中加入的沉淀劑為NaOH 組卷:10引用:2難度:0.6
三、【化學?選修2:化學與技術】
-
11.某合成氨廠與硝酸廠進行聯合生成,工藝流程如圖1:
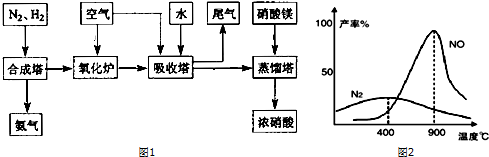
(1)工業生產氨氣的方法。
(2)下列試劑不能代替硝酸鎂加入到蒸餾塔中的是
A.濃硫酸 B.氯化鈣 C.濃磷酸 D.生石灰
(3)可持續發展要求化工生產工藝符合“綠色化學”或“節能環保”的要求,下列生產過程符合上述要求的是。
A.工業合成氨:用反應余熱加熱原料氣體
B.工業制硝酸:增高排放尾氣煙囪的高度
C.降低PM2.5:提高燃油冶煉技術,大力推廣97號汽油的使用
D.工業制膽礬:向稀硫酸中吹空氣并加熱溶解銅
(4)25℃時合成氨反應的熱化學方程式為N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol。該溫度下,將1molN2和3molH2充入密閉容器中,在催化劑存在下進行反應。測得反應放出的熱量小于92.4kJ,原因是。
(5)145℃氨氣和氧氣就開始反應,隨著反應的進行,溫度不斷升高,在不同溫度下生成不同產物(如圖2所示):
①4NH3(g)+5O2(g)?4NO(g)+6H2O
②4NH3(g)+3O2(g)?2N2(g)+6H2O (l)△H=-b kJ?mol-1
溫度高于900℃時,NO產率下降的原因是。吸收塔中需要補充空氣的原因是。
N2;氨氣氧化生成NO的反應是放熱反應,升高溫度轉化率下降;
(6)該工廠將氨氣用于后續生產。
①尿素是一種含氮量較高的氮肥,工業生產尿素是將氨氣與二氧化碳在加壓、加熱的條件下反應生成氨基甲酸銨(H2NCOONH4),再使氨基甲酸銨脫水得到尿素。生產過程中發生化學反應的化學方程式為、。
②用NH3制備NH4NO3,已知由NH3制NO的產率是96.0%、NO制HNO3的產率是92.0%,為獲得最多的產品,則與HNO3直接反應的NH3的質量占耗用全部NH3質量的。組卷:1引用:1難度:0.5
四、【化學?選修3:物質結構與性質】
-
12.第ⅥA族的氧、硫、硒(Se)、蹄(Te)等元素在化合物中常表現出多種氧化態,含第ⅥA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題:
(1)在基態O中,核外存在18對自旋方向相反的電子;在元素周期表中N、O、F三種元素相鄰,這三種元素的第一電離能由小到大的順序是.
(2)光氣(COCl2)中碳氧原子間共價鍵的類型有;如圖1為氧化石墨烯的結構示意圖,其中C的雜化方式為;若將氧化石墨烯分散在H2O中,則氧化石墨烯中可與H2O形成氫鍵的原子有(填元素符號).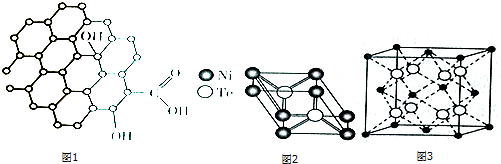
(3)Se在元素周期表中的位置是,基態Se原子的核外電子排布式為.
(4)Te與Ni形成的一種化合物晶體的晶胞結構如圖2所示,則該化合物的化學式為;Ni能形成多種化合物,Ni(CO)4是一種無色液體,沸點為42.1℃,熔點為-19.3℃.Ni(CO)4的晶體類型是.
(5)硒化銣晶體屬于反螢石型結構,晶胞結構如圖3所示,其中Se2-周圍與它距離最近且相等的Rb+ 的數目為.組卷:62引用:2難度:0.3


