2016-2017學年湖南省株洲市茶陵三中高二(上)開學化學試卷
發布:2024/11/10 15:30:2
一.選擇題(48分只有一個正確答案)
-
1.黑火藥是中國古代的四大發明之一,其爆炸的熱化學方程式為:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ?mol-1
已知:
碳的燃燒熱△H1=akJ?mol-1
S(s)+2K(s)═K2S(s)△H2=bkJ?mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=ckJ?mol-1
則x為( )A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b 組卷:1161引用:107難度:0.9 -
2.下列說法不正確的是( )
A.金屬單質和鹽溶液的反應不一定是置換反應 B.質量數相等的不同核素,一定屬于不同種元素 C.某溶液中加入BaCl2溶液,產生不溶于稀硝酸的白色沉淀,則原溶液中一定有SO4 2- D.Al2O3既能與強酸反應,又能與強堿反應,Al2O3屬于兩性氧化物 組卷:91引用:2難度:0.7 -
3.如圖為元素周期表中短周期的一部分,下列說法正確的是( )
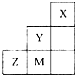
A.非金屬性:Y>Z>M B.離子半徑:M->Z2->Y- C.ZM2分子中各原子的最外層均滿足8電子穩定結構 D.三種元素中,Y的最高價氧化物對應的水化物酸性最強 組卷:119引用:6難度:0.9 -
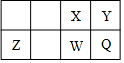 4.短周期元素X、Z、W、Q在元素周期表中的位置如圖所示,其中X元素原子最外層電子數是最內層電子數的3倍,則下列說法正確的是( )
4.短周期元素X、Z、W、Q在元素周期表中的位置如圖所示,其中X元素原子最外層電子數是最內層電子數的3倍,則下列說法正確的是( )A.X、W能與鈉形成摩爾質量相同的化合物,且陰陽離子數比為1:2 B.含X和Z元素的常見化合物為分子晶體 C.氧化物對應的水化物酸性:W<Q D.原子半徑大小關系:Q>W>Z>Y 組卷:32引用:3難度:0.9 -
5.硫酸亞鐵銨[(NH4)2Fe(SO4)2]是一種重要的化工原料,下列有關說法正確的是( )
A.Na+、Fe3+、 、Cl2都可在該物質的溶液中大量共存NO-3B. 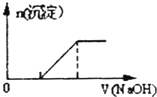
向0.1mol-L-1該物質的溶液中添加0.1mol?L-1NaOH溶液,生成沉淀的物質的量與逐滴加入NaOH溶液體積關系如圖所示C.檢驗該物質中Fe2+是否變質的方法是向該物質的溶液中滴入幾滴KSCN溶液,觀察溶液是否變紅色 D.向該物質的溶液中滴加Ba(OH)2溶液,恰好使 完全沉淀的離子方程式為:Fe2++2SO2-4+3Ba2++2OH-═2BaSO4↓+Fe(OH)2↓SO2-4組卷:87引用:6難度:0.5
二、填空題(共5小題,每小題14分,滿分52分)
-
16.磷化鋁、磷化鋅、磷化鈣是我國目前最常見的熏蒸殺蟲劑,都能與水或酸反應產生有毒氣體膦(PH3)PH3具有較強的還原性,能在空氣中自燃.我國糧食衛生標準規定,糧食中磷化物(以PH3計)含量≤0.05mg/kg.
某化學興趣小組的同學通過下列方法對糧食中殘留磷化物含量進行研究:
【實驗課題】.
【實驗原理】
5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
【操作流程】
安裝蒸餾吸收裝置→PH3的產生與吸收→轉移褪色→亞硫酸鈉標準溶液滴定
【實驗裝置】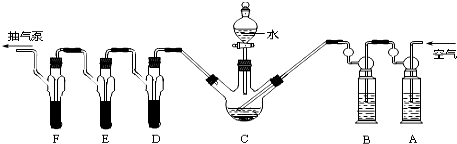
A、D、E、F各裝1.00mL濃度為5.00×10-4 mol/L的酸性KMnO4溶液,B中裝堿性焦性沒食子酸(1,2,3-三羥基苯),C中裝200g原糧.
(1)實驗課題的名稱是.
(2)以磷化鋁為例,寫出磷化物與水反應的化學方程式.
(3)檢查上述裝置氣密性的方法是.
(4)A中盛裝KMnO4溶液是為除去空氣中可能含有的(填“氧化性”、“還原性”) 氣體;B中盛裝堿性焦性沒食子酸溶液的作用是;如去除B裝置,則實驗中測得的PH3含量將(填偏大、偏小或不變).
(5)將D、E、F三裝置中的吸收液、洗滌液一并置于錐形瓶中,加水稀釋至25mL,用濃度為2.5×10-4 mol/LNa2SO3標準溶液滴定剩余的KMnO4溶液,消耗Na2SO3標準溶液11.00mL,則該原糧中磷化物(以PH3計)的含量為mg/kg.組卷:7引用:1難度:0.3 -
17.明礬石經處理后得到明礬[KAl(SO4) 2?12H2O].從明礬制備Al、K2SO4和H2SO4的工藝過程如圖1所示:
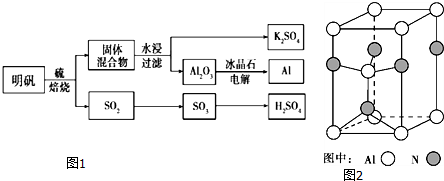
焙燒明礬的化學方程式為:4KAl(SO4) 2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O
請回答下列問題:
(1)在焙燒明礬的反應中,還原劑是.
(2)從水浸后的濾液中得到K2SO4晶體的方法是.
(3)Al2O3在一定條件下可制得AlN,其晶體結構如圖2所示,該晶體中Al的配位數是.
(4)以Al和NiO(OH) 為電極,NaOH溶液為電解液組成一種新型電池,放電時NiO(OH) 轉化為Ni(OH) 2,該電池反應的化學方程式是.
(5)焙燒產生的SO2可用于制硫酸.已知25℃、101kPa時:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
H2O(g)═H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.
則SO3(g) 與H2O(l) 反應的熱化學方程式是.
焙燒948t明礬(M=474g/mol),若SO2的利用率為96%,可生產質量分數為98%的硫酸t.組卷:12引用:1難度:0.3


