人教版(2019)選擇性必修1《1.2 反應熱的計算》2020年同步練習卷(3)
發布:2024/4/20 14:35:0
-
1.下列與化學反應能量變化相關的敘述正確的是( )
A.生成物總能量一定低于反應物總能量 B.放熱反應的反應速率總是大于吸熱反應的反應速率 C.應用蓋斯定律,可計算某些難以直接測量的反應焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 組卷:1196引用:169難度:0.9 -
2.反應X+Y═M+N的能量變化關系如圖所示。下列關于該反應的說法中,正確的是( )
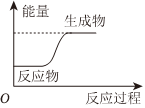
A.斷裂X、Y的化學鍵所吸收的能量小于形成M、N的化學鍵所放出的能量 B.X、Y的總能量一定低于M、N的總能量 C.因為該反應為吸熱反應,故一定要加熱才可發生 D.X的能量一定低于M的,Y的能量一定低于N的 組卷:226引用:5難度:0.7 -
3.MgCO3和CaCO3的能量關系如圖所示(M=Ca、Mg):
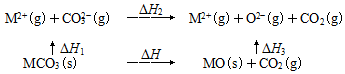
已知:離子電荷相同時,半徑越小,離子鍵越強。下列說法不正確的是( )A.△H1(MgCO3)>△H1(CaCO3)>0 B.△H2(MgCO3)=△H2(CaCO3)>0 C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO) D.對于MgCO3和CaCO3,△H1+△H2>△H3 組卷:649引用:28難度:0.6 -
4.氫氣和氮氣一定條件下反應生成氨氣.已知 H-H 鍵、N≡N、H-N 鍵能分別為Q1、Q2、Q3kJ?mol-1.下列關系式中正確的是( )
A.3Q1+3Q2<2Q3 B.Q1+Q2<Q3 C.3Q1+Q2<6Q3 D.3Q1+Q2<2Q3 組卷:104引用:8難度:0.7 -
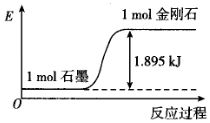 5.石墨轉化為金剛石過程中的能量變化如圖所示,下列說法中不正確的是( )
5.石墨轉化為金剛石過程中的能量變化如圖所示,下列說法中不正確的是( )A.該反應為吸熱反應 B.由圖示可知金剛石比石墨穩定 C.該反應中的能量變化主要原因是由化學鍵的斷裂和形成 D.若要使2mol石墨完全轉化為2mol金剛石,則要吸收3.79kJ的能量 組卷:15引用:1難度:0.7 -
6.在催化劑作用下,H2O2發生分解,其反應能量隨反應的進程變化如圖,下列說法正確的是( )
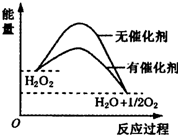
A.H2O2分解反應的△H>0 B.催化劑的加入使反應的熱效應減小 C.催化劑的加入提高了H2O2的分解率 D.催化劑通過改變反應歷程、降低反應的活化能來提高H2O2分解速率 組卷:206引用:5難度:0.7 -
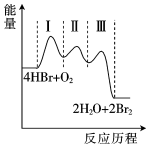 7.催化氧化HBr分為如下Ⅰ、Ⅱ、Ⅲ三步反應,三步反應的反應歷程曲線如圖所示。
7.催化氧化HBr分為如下Ⅰ、Ⅱ、Ⅲ三步反應,三步反應的反應歷程曲線如圖所示。
(Ⅰ)HBr(g)+O2(g)→HOOBr(g)
(Ⅱ)HOOBr(g)+HBr(g)→2HOBr(g)
(Ⅲ)HOBr(g)+HBr(g)→H2O(g)+Br2(g)
其中屬于放熱反應的有( )A.0個 B.1個 C.2個 D.3個 組卷:18引用:1難度:0.8 -
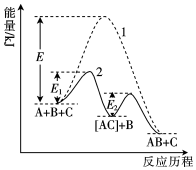 8.分別在有、無催化劑下進行反應A(g)+B(g)═AB(g),其能量與反應歷程如圖所示。下列說法正確的是( )
8.分別在有、無催化劑下進行反應A(g)+B(g)═AB(g),其能量與反應歷程如圖所示。下列說法正確的是( )A.“1”表示有催化劑 B.“2”的兩步反應均是放熱過程 C.催化劑可以改變反應的焓變 D.反應A(g)+B(g)═AB(g)△H=(E1-E2)kJ?mol-1 組卷:13引用:1難度:0.7
-
23.氨是一種重要的化工原料,在化工、食品、醫藥等行業有著廣泛的用途。回答下列問題:
(1)氮氧化物(NO、NO2)可導致大氣污染。工業上一般采用NH3無害化處理含氮氧化物的尾氣。
①處理NO尾氣。已知下列反應:
ⅰ.4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H1=-1632.4kJ?mol-1;
ⅱ.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H2=-902.0kJ?mol-1。
則4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=
②處理NO2尾氣。已知反應:8NH3(g)+6NO2(g)?7N2(g)+12H2O(l)△H<0。相同條件下,在容積均為2L的三個密閉容器中,分別通入3.2mol NH3、2.4mol NO2,在甲、乙、丙三種不同的催化劑作用下進行上述反應,用傳感器測得容器內N2的物質的量的變化如圖1所示。催化劑甲作用下,0?6min內反應速率V(NO2)=,三種催化劑作用下的反應活化能最大的是(填“甲”、“乙”或“丙”),反應達到平衡時,△H甲、△H乙、△H丙的關系是。
a.△H甲>△H乙>△H丙
b.△H甲=△H乙=△H丙
c.△H甲<△H乙<△H丙
(2)氮化鎵(GaN)是一種半導體材料。高溫條件下,氨氣和鎵反應可制備GaN:2Ga(s)+2NH3(g)═2GaN(s)+3H2(g)△H=-30.81kJ?mol-1。在一恒容密閉容器中加入足量Ga,通入一定量NH3發生上述反應,測得平衡時容器內NH3的體積分數與溫度、壓強關系如圖2所示。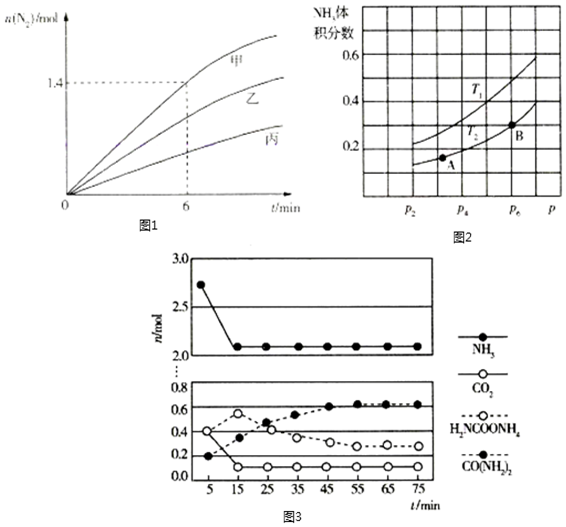
T1、T2的關系是T1(填“>”或“<”)T2,已知B點對應體系總壓強為P6,則A點用壓強表示的平衡常數KP=。
(3)尿素是農業生產的主要氮肥之一。工業上通常以NH3和CO2為原料生產尿素[CO(NH2)2],該反應由反應ⅰ和反應ⅱ兩步完成:
反應ⅰ:2NH3(g)+CO2(g)?H2NCOONH4(s)△H<0;
反應ⅱ:H2NCOONH4(s)?CO(NH2)2(s)+H2O(g)△H>0。
在實驗室中利用上述方法合成尿素,一定條件下,往一恒容密閉容器中通入4mol NH3和1mol CO2進行實驗,實驗過程中測得容器內部分組分的物質的量隨時間的變化如圖3所示。則上述反應歷程中,反應(填“ⅰ”或“ⅱ”)是快反應,總反應進行到55min時達到平衡狀態,該反應中NH3合成尿素的轉化率為。已知55min時,n[CO(NH2)2]=0.61mol。組卷:9引用:1難度:0.4 -
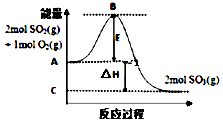 24.按要求完成下列問題:
24.按要求完成下列問題:
(1)反應2SO2(g)+O2(g)═2SO3(g)的能量變化如圖所示。已知2mol SO2(g)被氧化為2mol SO3(g)時的放熱198kJ。
請回答下列問題:
①圖中A點表示;C點表示2mol SO3(g)的總能量,E所代表的能量是。
②圖中△H=kJ?mol-1。
(2)在1.01×105 Pa時,4g氫氣在O2中完全燃燒生成液態水,放出572kJ的熱量,則H2的燃燒熱=。
(3)在1.01×105 Pa時,16gS在足量的氧氣中充分燃燒生成二氧化硫,放出148.5kJ的熱量,則S燃燒的熱化學方程式為。
(4)N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ?mol-1,若將1mol N2(g)和3mol H2(g)放在一密閉容器中進行反應,測得反應放出的熱量(填“大于”、“等于”或“小于”)92.2kJ,原因是。組卷:12引用:2難度:0.7


