2009-2010學年河北省唐山一中高二(上)開學調研化學試卷(9月份)
發布:2024/4/20 14:35:0
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.下列說法中正確的是( )
A.0.1mol/LHCl和0.1mol/LH2SO4與相同形狀和大小的大理石反應速率相同 B.大理石塊與大理石粉分別同0.1mol/L鹽酸反應速率相同 C.Mg、Al在相同條件下分別與0.1mol/L鹽酸反應,其反應速率相同 D.0.1mol/LHCl和0.1mol/LHNO3與相同形狀和大小的大理石反應,速率相同 組卷:23引用:6難度:0.7 -
2.在一個密閉容器中發生如下反應:2SO2(g)+O2(g)?2SO3(g),反應過程中某一時刻測得SO2、O2、SO3的濃度分別為:0.2mol/L,0.2mol/L,0.2mol/L,當反應達到平衡時,可能出現的數據是( )
A.c(SO3)=0.4mol/L B.c(SO2)=c(SO3)=0.15mol/L C.c(SO2)=0.25mol/L D.c(SO2)+c(SO3)=0.5mol/L 組卷:51引用:4難度:0.9 -
3.下列是4位同學在學習“化學反應的速率和化學平衡“一章后,聯系工業生產實際所發表的觀點,你認為不正確的是( )
A.化學反應速率理論是研究怎樣在一定時間內快出產品 B.化學平衡理論是研究怎樣使用有限原料多出產品 C.化學反應速率理論是研究怎樣提高原料轉化率 D.化學平衡理論是研究怎樣使原料盡可能多地轉化為產品 組卷:356引用:61難度:0.9 -
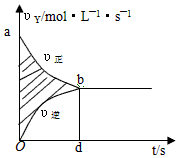 4.在容積固定的4L密閉容器中,進行可逆反應:X(g)+2Y(g)?2Z(g)并達到平衡,在此過程中,以Y的濃度改變表示的反應速率v(正)、v(逆)與時間t的關系如圖所示.則圖中陰影部分面積表示( )
4.在容積固定的4L密閉容器中,進行可逆反應:X(g)+2Y(g)?2Z(g)并達到平衡,在此過程中,以Y的濃度改變表示的反應速率v(正)、v(逆)與時間t的關系如圖所示.則圖中陰影部分面積表示( )A.X的濃度的減少 B.Y物質的量的減少 C.Z的濃度的增加 D.X物質的量的減少 組卷:300引用:21難度:0.5 -
5.反應2A(g)?2B(g)+C(g),正反應吸熱,達平衡時,要使v正降低、c(A)增大,應采取的措施是( )
A.加壓 B.減壓 C.減小c(B) D.降溫 組卷:6引用:3難度:0.7 -
6.一定條件下反應mA(g)+nB(g)
 pC(g)+qD(g)在一密閉容器中進行,測得平均反應速度v(C)=2v(B).若反應達平衡后保持溫度不變,加大體系壓強時平衡不移動,則m、n、p、q的數值可以是( )
pC(g)+qD(g)在一密閉容器中進行,測得平均反應速度v(C)=2v(B).若反應達平衡后保持溫度不變,加大體系壓強時平衡不移動,則m、n、p、q的數值可以是( )A.2、6、3、5 B.3、1、2、2 C.3、1、2、1 D.1、3、2、2 組卷:92引用:14難度:0.5 -
7.某溫度下,密閉容器中發生反應aX(g)?bY(g)+cZ(g),達到平衡后,保持溫度不變,將容器的容積壓縮到原來容積的一半,當達到新平衡時,物質Y和Z的濃度均是原來的1.8倍.則下列敘述正確的是( )
A.可逆反應的化學計量數:a>b+c B.壓縮容器的容積時,v正增大,v逆減小 C.達到新平衡時,物質X的轉化率減小 D.達到新平衡時,混合物中Z的質量分數增大 組卷:104引用:48難度:0.7
二、填空題(共4小題,滿分31分)
-
21.在一個容積為5L的密閉容器中,通入NH3和O2,它們的物質的量之比為1:2,發生如下反應:4NH3+5O2
 4NO+6H2O(g).
4NO+6H2O(g).
(1)上述反應在一定條件下2min后達到平衡,含NH32mol,已知NH3的轉化率20%,若以NO濃度變化表示該反應的平均反應速率為,O2的平衡濃度為.
(2)在達到平衡后,加入相當于原組成氣體1倍的惰性氣體,如果容器的容積不變,則平衡移動;如果保持總壓強不變,則平衡移動.組卷:5引用:1難度:0.5
四、計算題(本題6分)
-
22.某溫度下,可逆反應2NO2
 N2O4達平衡時,測得混合氣體的密度是相同條件下氫氣的36倍,求:
N2O4達平衡時,測得混合氣體的密度是相同條件下氫氣的36倍,求:
(1)此混合氣體中NO2與N2O4的物質的量之比.
(2)若反應溫度與容器容積不變,開始輸進的是N2O4氣,從逆向反應達平衡時,求N2O4的轉化率.組卷:0引用:1難度:0.3


