2020-2021學年廣東省廣州市天河中學高二(上)期中化學試卷
發布:2024/11/25 0:0:2
一、單項選擇題(共10小題,每題只有一個正確選項,每題2分,共20分)
-
1.下列有關說法正確的是( )
A.反應CaCO3(s)=CaO(s)+CO2(g)的△H>0、△S<0 B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常溫下自發進行,則該反應的△H>0 C.生命的過程是對抗熵增的過程 D.能自發進行的反應速率一定很快 組卷:6引用:1難度:0.5 -
2.一定條件下,在恒溫、恒容的密閉容器中模擬合成氨反應,其中達到平衡狀態的是( )
A.容器內的壓強不再變化 B.N2、H2、NH3的分子數之比為1:3:2 C.單位時間內生成2 mol NH3,同時消耗1 mol N2 D.v(N2)=3v(H2) 組卷:19引用:3難度:0.6 -
3.化學用語是學習化學的重要工具,下列表示物質變化的化學用語中,錯誤的是( )
A.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7;SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O B.明礬水解的離子方程式:Al3++3H2O=Al(OH)3↓+3H+ C.K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,其平衡常數K的表達式為K= c(CrO2-4)?c2(H+)c(Cr2O2-7)D.硫氫根電離的離子方程式:HS-+H2O?H3O++S2- 組卷:5引用:1難度:0.5 -
4.下列裝置或操作能達到目的的是( )
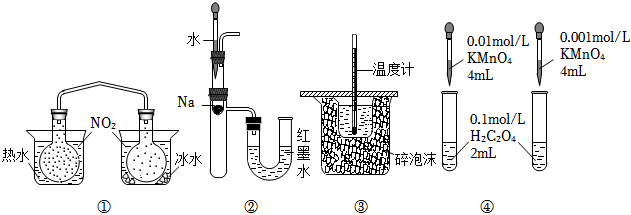
A.裝置①依據兩容器內氣體顏色變化,判斷反應2NO2(g)?N2O4(g)平衡移動的方向 B.裝置②依據U管兩邊液面的高低判斷Na和水反應的熱效應 C.裝置③測定中和熱 D.裝置④依據褪色快慢比較濃度對反應速率的影響 組卷:16引用:4難度:0.7 -
5.下列過程或現象與鹽類的水解無關的是( )
A.加熱氯化鐵溶液的顏色變深 B.CaCO3飽和溶液pH約為9.3 C.加熱純堿溶液,可以增強其去污能力 D.NaHCO3做發酵粉時加入檸檬酸后效果更好 組卷:6引用:1難度:0.5 -
6.常溫下,關于pH=2的鹽酸,下列說法不正確的是( )
A.溶液中c(H+)=1.0×10-2 mol?L-1 B.加入等體積pH=12的Ba(OH)2溶液,溶液呈堿性 C.此溶液中由水電離出的H+和OH-濃度均為1.0×10-12 mol?L-1 D.加水稀釋100倍后,溶液的pH=4 組卷:16引用:1難度:0.7
二、非選擇題(共56分)
-
 19.航天員呼吸產生的CO2用下列反應處理,可實現空間站中O2的循環利用,Sabatier反應:
19.航天員呼吸產生的CO2用下列反應處理,可實現空間站中O2的循環利用,Sabatier反應:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
水電解反應:2H2O(l)2H2(g)+O2(g)電解
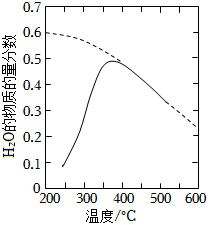
(1)將原料氣按n(CO2):nH2=1:4置于密閉容器中發生Sabatier反應,測得H2O(g)的物質的量分數與溫度的關系如圖所示(虛線表示平衡曲線)。
①該反應的平衡常數K隨溫度升高而(填“增大”或“減小”)。
②溫度過高或過低均不利于該反應的進行,原因是。
③200℃達到平衡時體系的總壓強為p,該反應平衡常數Kp的計算式為。(不必化簡。用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
(2)Sabatier反應在空間站運行時,下列措施能提高CO2轉化效率的是(填標號)。
A.適當減壓
B.增大催化劑的比表面積
C.反應器前段加熱,后段冷卻
D.提高原料氣中CO2所占比例
E.合理控制反應器中氣體的流速
(3)一種新的循環利用方案是用Bosch反應CO2(g)+2H2(g)?C(s)+2H2O(g)代替Sabatier反應。
①已知CO2(g)、H2O(g)的生成焓分別為-394kJ?mol-1、-242kJ?mol-1,Bosch反應的△H=kJ?mol-1.(生成焓指一定條件下由對應單質生成1mol化合物時的反應熱)
②一定條件下Bosch反應必須在高溫下才能啟動,原因是。
③新方案的優點是。組卷:69引用:6難度:0.3 -
20.某化學小組通過查閱資料,設計了如圖所示的方法以含鎳廢催化劑為原料來制備NiSO4?7H2O。已知某化工廠的含鎳廢催化劑主要含有Ni,還含有Al(31%)、Fe(1.3%)的單質及氧化物,其他不溶雜質(3.3%).
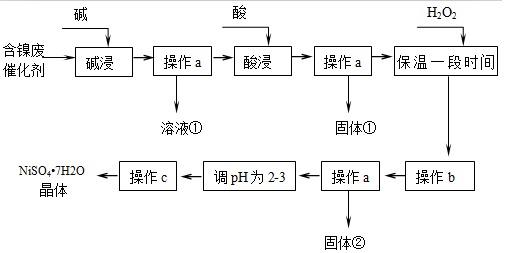
部分陽離子以氫氧化物形式沉淀時的pH如圖表所示:
(1)溶液①中的陰離子有沉淀物 開始沉淀時的pH 完全沉淀時的pH Al(OH)3 3.8 5.2 Fe(OH)3 2.7 3.2 Fe(OH)2 9.7 Ni(OH)2 7.1 9.2 “酸浸”時所加入的酸是(填化學式).
(2)加入H2O2時發生反應的離子方程式,操作b為調節溶液的pH,你認為pH的調控范圍是。
(3)操作C之前調節pH為2-3的目的是。
(4)操作不當往往令產品中混有少量綠礬(FeSO4?7H2O,M=280g/mol),可用下述方法測出產品純度。稱取50克該產品晶體配成100mL溶液,取20mL.該溶液用0.1mol/L的酸性KMnO4溶液滴定,消耗酸性KMnO4溶液10mL(Ni2+不被氧化)則該產品晶體的純度是。組卷:3引用:1難度:0.5


