2020-2021學年四川省成都市石室中學高三(上)入學化學試卷
發布:2024/4/20 14:35:0
一、(選擇題,共44分)本卷共22題,每題2分,共44分。每題只有一個選項符合題意。
-
1.紀錄片《我在故宮修文物》表現了文物修復者穿越古今與百年之前的人進行對話的職業體驗,讓我們領略到歷史與文化的傳承。下列文物修復和保護的過程中涉及化學變化的是( )
A B C D




銀器用除銹劑見新 變形的金屬香爐復原 古畫水洗除塵 木器表面擦拭燙蠟 A.A B.B C.C D.D 組卷:165引用:27難度:0.6 -
2.下列化學用語不正確的是( )
A.質子數為8、中子數為10的氧原子: O188B.比例模型 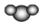 ,不能表示二氧化碳,可以表示水分子
,不能表示二氧化碳,可以表示水分子C.碳正離子(CH3+)的電子式為 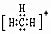
D.氫氧燃料電池的正極反應式可能為:O2+2H2O+4e-═4OH- 組卷:9引用:1難度:0.6 -
3.下列說法中不正確的是( )
A.淀粉、纖維素、蔗糖水解的最終產物都相同 B.相同條件下的沸點順序:戊烷>丁烷>丙烷 C.CCl4可由CH4制得,可萃取碘水中的碘 D.乙醇能被酸性高錳酸鉀溶液直接氧化成乙酸 組卷:40引用:1難度:0.6 -
4.用NA表示阿伏加德羅常數的值。下列敘述中正確的是( )
A.密閉容器中,2mol SO2和1mol O2催化反應后分子總數為2NA B.標況下,11.2L的HF所含分子數為0.5NA C.100mL 1mol?L-1FeCl3溶液中所含Fe3+的數目小于0.1NA D.室溫下,pH=12的Ba(OH)2溶液中Ba2+的數目為5×10-3NA 組卷:14引用:1難度:0.6 -
5.如圖是某品牌飲用礦泉水標簽的部分內容。下列說法正確的是( )

A.標簽上離子的濃度是物質的量濃度 B.由礦泉水制蒸餾水必需使用的玻璃儀器有:圓底燒瓶、溫度計、冷凝管、牛角管和錐形瓶 C.該品牌飲用礦泉水中c(Mg2+)最大值為2×10-4mol/L D.一瓶該品牌飲用礦泉水中SO42-的物質的量不超過l×10-5mol 組卷:61引用:5難度:0.6 -
6.H2O2(l)在有MnO2條件下和無MnO2條件下分解的能量變化如圖所示。下列說法正確的是( )

A.有MnO2條件下的反應曲線是a曲線 B.該反應能量變化類型與CaCO3分解反應相同 C.加催化劑后,正反應速率加快,逆反應速率減小 D.b曲線的熱化學方程式為:H2O2(l)=H2O(l)+ O2(g)ΔH=( E1-E2 )kJ?mol-112組卷:88引用:5難度:0.7 -
7.下列關于有機物(
 )的說法錯誤的是( )
)的說法錯誤的是( )A.該分子中的5個碳原子可能共面 B.與該有機物含相同官能團的同分異構體只有3種 C.通過加成反應可分別制得烷烴、醇、鹵代烴 D.鑒別該有機物與戊烷可用酸性高錳酸鉀溶液 組卷:36引用:3難度:0.6 -
8.用下列實驗裝置(部分夾持裝置略去)進行相應的實驗,能達到實驗目的的是( )
A. 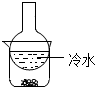
加熱裝置中的燒杯分離I2和高錳酸鉀固體B. 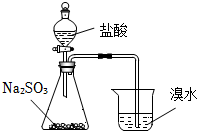
用裝置驗證二氧化硫的漂白性C. 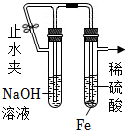
用裝置制備氫氧化亞鐵沉淀D. 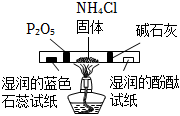
用裝置檢驗氯化銨受熱分解生成的兩種氣體組卷:296引用:18難度:0.6 -
9.研究表明,氮氧化物和二氧化硫在形成霧霾時與大氣中的氨有關(如圖所示)。下列敘述錯誤的是( )
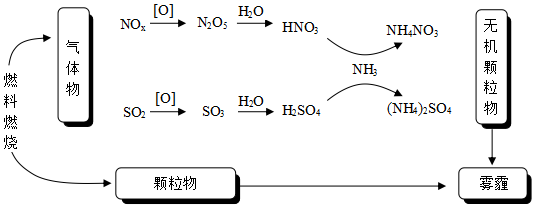
A.霧和霾的分散劑相同 B.霧霾中含有硝酸銨和硫酸銨 C.NH3是形成無機顆粒物的催化劑 D.霧霾的形成與過度施用氮肥有關 組卷:1940引用:49難度:0.9
二、非選擇題,共56分)
-
26.酸性KMnO4溶液能與草酸(H2C2O4)溶液反應。某探究小組利用反應過程中溶液紫色消失快慢的方法來研究影響化學反應速率的因素。
Ⅰ.實驗前首先用濃度為0.1000mol?L-1酸性KMnO4標準溶液滴定未知濃度的草酸溶液。
(1)在酸性條件下能夠發生如下反應,請配平該反應離子方程式:MnO4-+H2C2O4+H+═Mn2++CO2↑+H2O
(2)取25.00mL待測草酸溶液于錐形瓶中,加入適量稀硫酸,用0.1000mol?L-1酸性高錳酸鉀溶液滴定,消耗KMnO4溶液20.00mL。
①滴定過程中操作滴定管的圖示正確的是。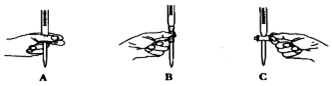
②滴定到達終點的判斷標志是。
③下列操作可能造成測得草酸溶液濃度偏高的是。
A.滴定終點讀數時俯視
B.滴定前有氣泡,滴定后氣泡消失
C.潤洗錐形瓶
D.滴定過程中加入少量蒸餾水沖洗瓶壁
④該草酸溶液的物質的量濃度為。(保留四位有效數字)
Ⅱ.用2mL 0.1000mol/L KMnO4溶液與4mL上述草酸溶液,研究不同條件對化學反應速率的影響。
(3)如果研究催化劑對化學反應速率的影響,使用實驗②和組別 10%硫酸體積/mL 溫度/℃ 加入其他物質 ① 2mL 20 ② 2mL 20 10滴飽和MnSO4溶液 ③ 2mL 30 ④ 1mL 20 (用①~④表示,下同);如果研究溫度對化學反應速率的影響,使用實驗③和。
(4)如果要利用實驗①和④,研究硫酸濃度對化學反應速率的影響,實驗④中加入。
(5)某同學對實驗②進行了三次實驗,測得溶液褪色時間如下表,則實驗②中用KMnO4來表示的化學反應速率為。(忽略混合前后溶液體積的變化)溶液褪色所需時間t/min 第一次 第二次 第三次 4.9 5.1 6.8 組卷:6引用:1難度:0.4 -
27.鐵、鈷、鎳性質非常相似,被稱為鐵系元素.鐵系元素在生產生活中有重要用途.
Ⅰ.氯化鈷可用于化學反應催化劑,油漆催干劑等.用金屬鈷板(含少量Fe、Ni)制備氯化鈷流程如圖.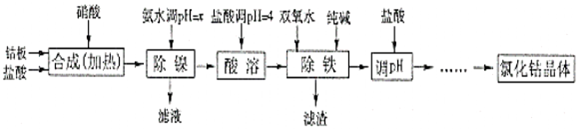
已知:
①鈷與鹽酸反應極慢,需加入催化劑硝酸才能進行實際生產.
②有關鈷、鎳和鐵化合物的性質見下表:
(1)實驗室測溶液pH要用到的玻璃儀器有化學式 沉淀完全時的pH 鈷鎳性質 Co(OH)2 9.4 Co+2HCl═CoCl2+H2↑Co2++2NH3?H2O=↓+2NH4+
Ni+2HCl═NiCl2+H2↑Co2++2H2O?+2H+
Ni2++6NH3?H2O═[Ni(NH3)6]2++6H2OFe(OH)2 9.6 Fe(OH)3 3.7 .
(2)“除鎳”步驟中,NH3?H2O用量對殘留Ni2+含量的影響見表:從表中可知x=時,除鎳效果最好.
(3)“除鐵”步驟中加入純堿的作用是(利用水解平衡原理并結合必要的文字作答)加氨水調pH Ni2+含量 9 0.08% 9.5 0.05% 10 0.005% 10.3 0.005% .
(4)加鹽酸調pH的目的是.
Ⅱ.當代技術利用鐵的氧化物循環裂解水制氫氣的過程如圖1所示.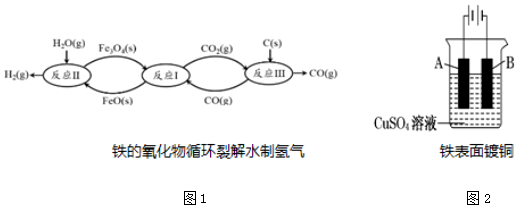
(5)已知:在20MPa、800℃下
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H1=+19.3k?mol-1
3FeO(s)+H2O(g)?Fe3O4(s)+H2(g)△H2=-57.2k?mol-1
C(s)+CO2(g)?2CO(g)△H3=+172.4k?mol-1
則該條件下,鐵氧化物循環裂解水制氫氣總反應的熱化學方程式是.
Ⅲ.我國鎳氫電池居世界先進水平.常見鎳氫電池的某極是儲氫合金LaNi5H6(LaNi5H6中各元素化合價均為零),電池反應通常表示為:LaNi5H6+6NiO(OH)═LaNi5+6Ni(OH)2.
(6)則該電池放電時負極反應式為:.
(7)用鎳氫電池做電源,在鐵件的表面鍍銅防止鐵被腐蝕.裝置示意圖如圖2所示.若電鍍前鐵、銅兩片金屬質量相同,電鍍完成后將它們取出洗凈、烘干、稱量,二者質量差為4.48g,則電鍍時電路中通過的電子的物質的量為.組卷:23引用:1難度:0.3


