魯科版(2019)必修第二冊(cè)《第2章 化學(xué)鍵、化學(xué)反應(yīng)規(guī)律》2021年單元測(cè)試卷(2)
發(fā)布:2024/4/20 14:35:0
一、單選題(共15小題)
-
1.如圖,下列裝置能產(chǎn)生有效電流的是( )
A. 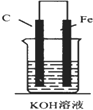
B. 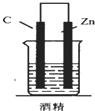
C. 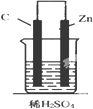
D.  組卷:8引用:2難度:0.9
組卷:8引用:2難度:0.9 -
2.依據(jù)氧化還原反應(yīng) 2Ag++Cu=Cu2++2Ag 設(shè)計(jì)的原電池如圖所示。下列有關(guān)說(shuō)法不正確的 是( )
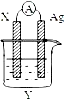
A.電極 X 的材料是 Cu B.電解質(zhì)溶液 Y 是 CuSO4 溶液 C.電子從 X 電極經(jīng)導(dǎo)線流向 Ag 電極 D.Ag 電極為電池的正極,電極反應(yīng)為 Ag++e-=Ag 組卷:23引用:2難度:0.5 -
3.下列關(guān)于化學(xué)鍵的認(rèn)識(shí)正確的是( )
A.分子間強(qiáng)烈的相互作用 B.同種原子間的相互作用 C.不同原子間強(qiáng)烈的相互作用 D.相鄰原子間強(qiáng)烈的相互作用 組卷:10引用:1難度:0.8 -
4.含有共價(jià)鍵的離子化合物是( )
A.H2O2 B.CaCl2 C.CCl4 D.NaOH 組卷:43引用:3難度:0.5 -
5.已知反應(yīng)H2(g)+I2(g)?2HI(g)中,每生成2 mol HI時(shí)會(huì)有a kJ 的能量放出,又知有關(guān)化學(xué)鍵鍵能如下:
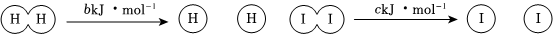
下列說(shuō)法正確的是( )A.1mol H2的能量比2 mol H 的能量高 B.將0.5 mol H2(g) 與1mol I2(g)混合充分反應(yīng)后放出的熱量為0.5a kJ C.H-I鍵的鍵能為0.5(a+b+c) kJ/mol D.H+I→HI 是吸熱變化 組卷:112引用:3難度:0.8 -
6.對(duì)于化學(xué)反應(yīng)aA(g)+bB(g)?cC(g),反應(yīng)開始時(shí)各物質(zhì)的濃度與3s時(shí)各物質(zhì)的濃度如表所示。則化學(xué)方程式中化學(xué)計(jì)量數(shù)a:b:c為( )
A B C 開始濃度/mol?L-1 2.0 1.0 3.0 3 s時(shí)濃度/mol?L-1 1.6 0.2 4.2 A.2:1:3 B.8:1:21 C.3:2:1 D.1:2:3 組卷:27引用:2難度:0.5 -
7.一定條件下,發(fā)生可逆反應(yīng)4NH3(g)+5O2(g)?4NO(g)+6H2O(g)下列敘述中,不能做為此可逆反應(yīng)已經(jīng)達(dá)到化學(xué)平衡狀態(tài)的標(biāo)志是( )
A.NH3的消耗速率等于NO的生成速率 B.NH3的消耗速率等于NO的消耗速率 C.NH3的濃度和NO的濃度都不發(fā)生改變 D.密閉容器內(nèi)的壓強(qiáng)不發(fā)生改變 組卷:26引用:5難度:0.7 -
8.如圖所示裝置,電流表指針發(fā)生偏轉(zhuǎn),同時(shí)A極逐漸變粗,B極逐漸變細(xì),C為電解質(zhì)溶液,則A、B、C應(yīng)是下列各組中的( )
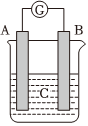
選項(xiàng) A B C A Zn Cu 稀硫酸. B Cu Fe 稀鹽酸 C Fe Ag Fe(NO3)3溶液 D Ag Fe AgNO3溶液 A.A B.B C.C D.D 組卷:17引用:1難度:0.6
四、填空題(共3小題)
-
23.某化學(xué)小組為了研究外界條件對(duì)化學(xué)反應(yīng)速率的影響,進(jìn)行了如下實(shí)驗(yàn):
[實(shí)驗(yàn)原理]2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O(用離子方程式表示)。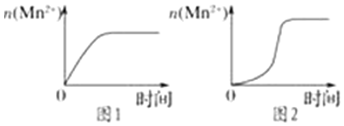
[實(shí)驗(yàn)內(nèi)容及記錄]
請(qǐng)回答:實(shí)驗(yàn)編號(hào) 室溫下,試管中所加試劑及其用量/mL 室溫下溶液顏色褪至無(wú)色所需時(shí)間/min 0.6mol/L H2C2O4溶液 H2O 0.2mol/L KMnO4溶液 3mol/L稀硫酸 1 3.0 2.0 3.0 2.0 4.0 2 3.0 3.0 2.0 2.0 5.2 3 3.0 4.0 1.0 2.0 6.4
(1)根據(jù)表中的實(shí)驗(yàn)數(shù)據(jù),可以得到的結(jié)論是。
(2)利用實(shí)驗(yàn)1中數(shù)據(jù)計(jì)算,用KMnO4的濃度變化表示的反應(yīng)速率為:v(KMnO4)=。
(3)該小組同學(xué)根據(jù)經(jīng)驗(yàn)繪制了n(Mn2+)隨時(shí)間變化趨勢(shì)的示意圖,如圖1所示,但有同學(xué)查閱已有的實(shí)驗(yàn)資料發(fā)現(xiàn),該實(shí)驗(yàn)過(guò)程中n(Mn2+)隨時(shí)間變化的趨勢(shì)應(yīng)如圖2所示。
該小組同學(xué)根據(jù)圖2所示信息提出了新的假設(shè),并繼續(xù)進(jìn)行實(shí)驗(yàn)探究。
①該小組同學(xué)提出的假設(shè)是。
②請(qǐng)你幫助該小組同學(xué)完成實(shí)驗(yàn)方案,并填寫表中空白。
③若該小組同學(xué)提出的假設(shè)成立,應(yīng)觀察到的現(xiàn)象是實(shí)驗(yàn)編號(hào) 室溫下,試管中所加試劑及其用量/mL 再向試管
中加入少
量固體室溫下溶液
顏色褪至無(wú)
色所需時(shí)間
/min0.6 mol/L H2C2O4 H2O 0.2 mol/L KMnO4溶液 3mol/L稀硫酸 4 3.0 2.0 3.0 2.0 t 。組卷:8引用:1難度:0.7 -
 24.能源是人類生活和社會(huì)發(fā)展的基礎(chǔ),研究化學(xué)應(yīng)用中的能量變化,有助于更好地利用化學(xué)反應(yīng)為生產(chǎn)和生活服務(wù)。
24.能源是人類生活和社會(huì)發(fā)展的基礎(chǔ),研究化學(xué)應(yīng)用中的能量變化,有助于更好地利用化學(xué)反應(yīng)為生產(chǎn)和生活服務(wù)。
(1)化學(xué)鍵斷裂和形成是化學(xué)反應(yīng)的本質(zhì)和化學(xué)反應(yīng)能量產(chǎn)生的原因。從能量的角度看,斷開舊化學(xué)鍵需要(填“吸收”或“放出”,下同)能量,形成新化學(xué)鍵需要能量。
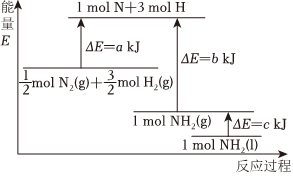
(2)已知化學(xué)反應(yīng)N2+3H22NH3的能量變化如圖所示:高溫、高壓催化劑
①1mol N和3mol H生成1mol NH3(g)是(填“吸收”或“釋放”)能量的過(guò)程。由mol N2(g)和12mol H2(g)生成1mol NH3(g)過(guò)程32(填“吸收”或“釋放”)kJ能量。
②已知斷開1mol H-H鍵、1mol N-H鍵、1mol N≡N鍵分別需要吸收的能量為436kJ、391kJ、946kJ。一定條件下由氫氣和氮?dú)夥磻?yīng)生成1mol NH3需要(填“放出”或“吸收”)kJ的能量。組卷:44引用:2難度:0.6


